
乳腺癌单病种分级诊疗专家共识编写组. 乳腺癌单病种分级诊疗专家共识(2025版)[J]. 中华肿瘤杂志, 2025, 47(10): 961-980. DOI: 10.3760/cma.j.cn112152-20250609-00266 .
乳腺癌是全球女性最常见的恶性肿瘤。2022年中国乳腺癌新发病例数约为35.7万例,死亡病例数约为7.5万例,严重危害女性健康。而中国医疗服务体系结构和承担的医疗服务呈现倒“三角形”格局,亟需建立合理的医疗服务体系,优化资源配置,确保患者能够在不同阶段获得适当的诊疗服务,以患者为中心加强诊疗连续性服务,进而提升整体治疗效果。因此,在分级诊疗的政策背景下,国家肿瘤质控中心乳腺癌专家委员会及国家卫生健康委卫生发展研究中心组织起草并制定了《乳腺癌单病种分级诊疗专家共识(2025版)》,旨在明确不同层级医疗机构分级功能定位,合理配置医疗资源,以建立基层首诊、双向转诊、急慢分治、上下联动的医疗卫生服务体系,提高乳腺癌“防、筛、诊、治、康”的全程管理效果,改善乳腺癌患者生存率和生活质量。
【关键词】乳腺肿瘤;分级诊疗;功能定位;以患者为中心;专家共识
乳腺癌是全球女性中最常见的恶性肿瘤,近年来在中国的发病率和死亡率逐年上升,已成为严重威胁女性健康的重要公共卫生问题。针对乳腺癌的早期筛查、诊断和治疗,国内外已经形成了较为完善的临床指南和共识。随着诊疗日趋规范,患者预后已得到显著改善,乳腺癌也已成为肿瘤慢病化管理典范。然而,由于我国地域广阔、经济发展水平不均、医疗资源分布不均等因素,患者在接受医疗服务时,其连续性得不到有力保障,故导致部分患者未能获得及时有效的治疗。
2024年10月,国家卫生健康委发布《关于加强首诊和转诊服务提升医疗服务连续性的通知》,旨在促进分级诊疗体系建设,进一步加强首诊和转诊服务,提升医疗服务连续性,改善患者就医体验,降低就医成本。通知中指出,到2025年底,紧密型医联体(包括城市医疗集团和县域医共体)内建立顺畅的双向转诊制度;以地级市为单位,建立医疗机构间转诊制度,方便患者在市域内转诊。到2027年,在省域内建立医疗机构间顺畅的转诊制度,畅通患者省域内转诊。到2030年,分级诊疗体系发挥有效作用,为患者提供系统连续、公平可及的医疗服务,形成规范有序的就医格局。
因此,在国家卫生健康委卫生发展研究中心及国家肿瘤质控中心乳腺癌专家委员会组织的倡导下,中国乳腺癌各学科诊疗专家组结合国内外最新的循证医学证据、治疗策略和诊疗经验,制定《乳腺癌单病种分级诊疗专家共识(2025版)》。主要内容包括乳腺癌分级诊疗规范化体系建设、“防、筛、诊、治、康”全病程管理以及分级诊疗质控指标等。该共识旨在在全病程管理中,为各医疗机构及医务工作者明确分级功能定位,合理配置医疗资源、促进基本医疗服务均等化;同时,引导乳腺癌患者根据病情选择相应的医疗机构就医并获得全病程管理,让乳腺癌患者得到优质、安全、适宜和连续性的医疗服务。
1. 我国乳腺癌的流行病学现状:2022年,我国新发乳腺癌病例数35.72万例,在女性常见恶性肿瘤中排名第2位,死亡病例数7.49万,位居第6位。近年来,随着乳腺癌治疗药物的不断创新和基于分子分型的精准诊疗模式建立,我国乳腺癌患者5年生存率已提升至83.2%,早期乳腺癌患者的5年生存率可以达到90%以上。
同时,我国乳腺癌患者5年生存率存在明显地域差异,据国家癌症中心2016年数据显示,我国目前城市乳腺癌患者的5年生存率为77.8%,农村乳腺癌患者的5年生存率仅55.9%,差异超过20%。此外,农村患者复发率(41.3%)高于城市患者(34.8%)。
2. 我国乳腺癌诊疗现状:乳腺癌防治手段丰富,伴随乳腺癌筛查早诊技术、手术、放射治疗、化学治疗、靶向治疗、内分泌治疗、免疫治疗等多学科综合诊疗技术的进步,乳腺癌患者的生存和预后较前明显改善。目前,采用综合治疗手段,乳腺癌已成为预后较好的实体肿瘤之一,为乳腺癌诊疗规范探索创造了条件。
一项针对中国30个地区共计185家医院开展的全国性的乳腺癌诊疗现状及医师观念调研结果显示,目前试点医院在质控工作中取得了阶段性的进展,在部分筛查及诊断指标中也有比较突出的表现,随着试点医院在各区域引领和示范作用放大,带动了大部分医师也在诊疗观念上体现出了与乳腺癌指南规范或专家共识匹配的先进性。
3. 我国乳腺癌的分级诊疗现状:我国人口基数大,乳腺癌患者数量多,分级诊疗能有效防止医疗资源的挤兑、优化医疗资源使用。党的十八大以来,我们立足国情实际,建设了13个类别的国家医学中心,开展125个国家区域医疗中心建设项目,设置114个省级区域医疗中心,1400余项诊疗技术在受援省(自治区、直辖市)得到应用,在全国诊疗人次逐年上涨的情况下,跨省和跨区域就医稳中有降。下一步,要进一步解决好区域医疗卫生体系建设和资源分布不平衡不充分的问题。
在推动基层首诊方面,加强基层医疗卫生机构标准化建设,扎实开展“优质服务基层行”活动,发展以全科医师为重点的基层人才队伍,实行家庭医师签约服务。2023年,全国累计达到服务能力标准的乡镇卫生院和社区卫生服务中心超过3万家,基层医疗卫生机构提供的门急诊诊疗人次占到52%,逐渐接近世界卫生组织所建议的基层医疗机构首诊率应在所有类型的机构中占到80%。
在促进双向转诊、上下联动方面,大力发展医疗联合体,在城市建设医疗集团,在县域打造紧密型医共体,以薄弱专科和重大疾病诊疗为重点,组建专科联盟,扩大优质资源辐射面,引导各级医疗卫生机构加强多学科协同服务。截至2023年底,全国建成各种形式的医联体1.8万余个,双向转诊人次数超过3032万,形成医疗资源纵向流动、患者双向转诊的新局面。其中,45.6%的县医院达到了三级医院能力,87.7%的县医院达到了二级医院能力,县级医院的医疗服务水平在稳步提升。据研究报道,上海市绝大多数患者表示愿意接受由社区转向上级医院(64.9%),而不愿意“上转下”的患者仍然居多(53.3%)。
在加强急慢分治方面,建立国家医学中心、国家区域医疗中心、省级区域医疗中心,建设胸痛、卒中、创伤等急诊急救中心,提高急危重症、疑难复杂疾病的诊断治疗水平。积极创新服务方式,发展远程医疗和互联网诊疗,为群众提供线上线下一体化服务,开展家庭病房、上门护理等居家服务,更有效地满足急危重症与慢性病患者的医疗服务需求,促进群众就医的分级分层分流。
目前,我国暂无针对乳腺癌单病种分级诊疗的研究数据,亟需补充,以利于合理配置医疗资源,实现医疗服务均等化。
(一)构建乳腺癌患者分级诊疗服务网络
随着诊断技术和局部/系统治疗的进步及外科手术的发展,乳腺癌患者的医疗服务模式正从以疾病为中心向以患者为中心的肿瘤创新诊疗模式转变。构建以患者为中心的乳腺癌分级诊疗服务网络旨在满足乳腺癌慢病化下患者治疗连续性的需求,并推进基层首诊,促进双向转诊、上下联动,加强急慢分治,提高患者的生活质量,并通过构建更好的医疗体系政策,整合社会资源,为患者提供成本效益优化的医疗服务。
乳腺癌患者分级诊疗服务网络主体结构由示范中心、规范中心以及防治中心构成。其中,乳腺癌防治中心应充分发挥基层网络基础作用,与医联体中的上级单位,如乳腺癌示范中心、规范中心建立紧密协作关系。通过医联体内部的资源共享机制互联互通,防治中心可获得上级单位的技术支持,包括远程会诊、专家指导等,提升防治中心医疗人员对乳腺癌的筛查与初步诊断能力。同时,借助医联体的协同效应,实现基层医疗机构与防治中心之间的患者有序转诊,确保就医通道的顺畅,患者能够得到及时、有效的诊疗服务。
(二)明确乳腺癌单病种分级诊疗流程
1. 建设三层级中心模式的完善诊疗路径:统筹现有医疗资源,设置乳腺癌示范中心,规范中心及防治中心的三层级医疗机构中心模式,依托专病联盟将不同行政区域的辖区内所有患者纳入中心进行管理。
2. 统筹专病联盟的功能布局和服务网络布局:(1)明确示范中心负责复杂疑难乳腺癌患者的诊疗工作及临床研究、基础研究转化工作,对规范中心、防治中心等卫生机构进行技术指导和业务培训,重点发挥在医学科学、技术创新和人才培养等方面的引领作用;(2)明确地市级规范中心负责乳腺癌常规疾病的临床诊断,按照诊疗指南、规范制定个体化、规范化的治疗方案;实施患者年度专科体检,并发症后续治疗;指导、实施双向转诊;(3)明确防治中心负责为诊断明确、病情稳定期乳腺癌患者、康复期患者提供康复、护理服务,定期接受上级医疗机构对医疗质量和治疗效果的评估。按照疾病诊疗指南、规范,配合上级医院做好患者随访和病情观察工作,落实上级医院制定的相关治疗方案。
3. 强化乳腺癌的分类分层及就诊转诊工作:紧密型县域医疗卫生共同体是防治中心中的主体,未来在促进全民健康中发挥出重要作用。加强基层医疗机构的县域肿瘤防治中心建设,优化医疗资源布局,提升基层诊疗能力,确保优质资源下沉,以实现“健康中国”战略目标。
基层医疗机构依托于县域乳腺癌防治中心对于市县区域内的重点人群进行筛查,并且及时按照以下分级原则进行管理和转诊(图1)。
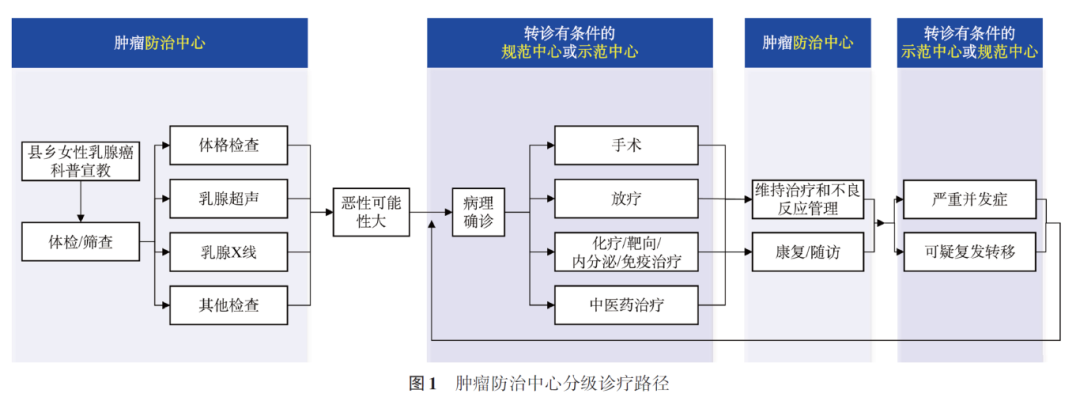
4. 落实专病协调和个案管理实现管理闭环:肿瘤诊治与管理的全流程中设置专病协调员统筹在各层级中心的患者转诊协调与病案管理工作,实现以服务患者为中心的医疗机构协同和联动作用(图2)。
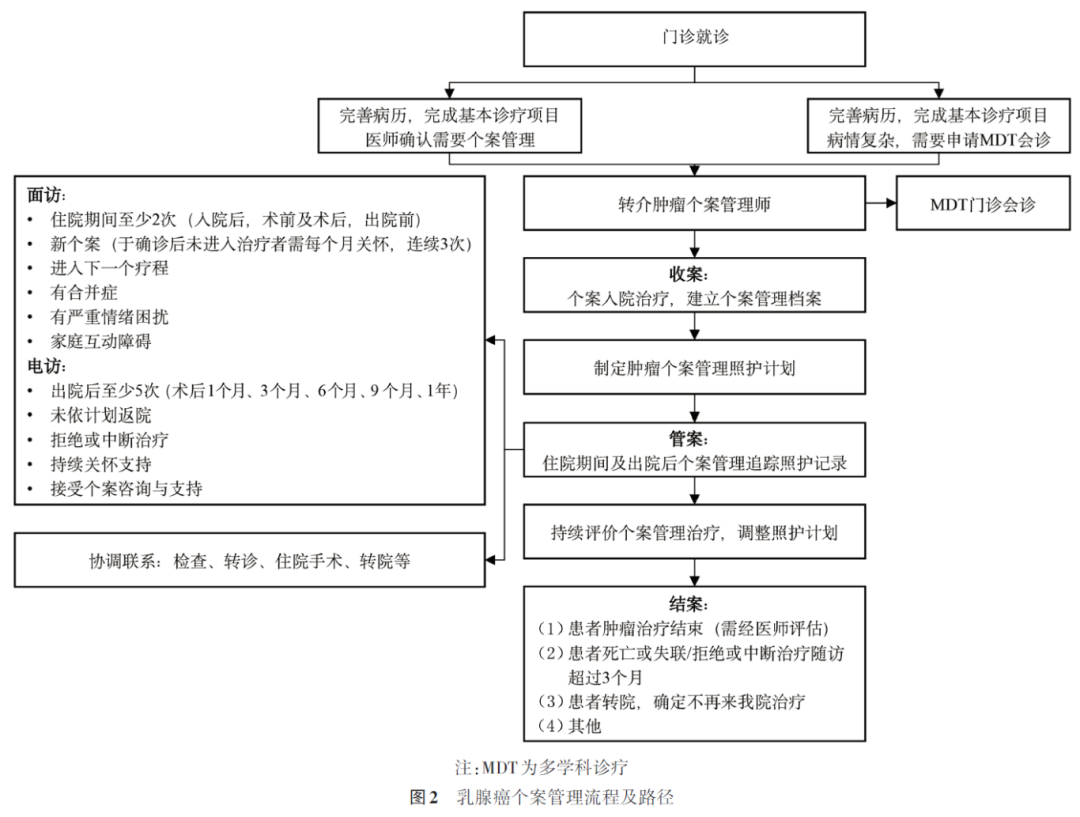
个案管理师是单层级医疗机构诊疗全流程的灵魂,负责统筹诊疗的全流程。肿瘤个案管理师为患者提供连续医疗服务,确保治疗各环节的紧密衔接。主要职责在于依患者需求提供治疗信息,协助患者与治疗团队沟通,帮助患者及家属了解治疗计划,以利个案与照顾者进行决策,同时监测患者治疗过程的异常现象,并且参与多专科团队会议,并协助个案照护相关决议事项追踪。此外负责患者的临床照护,依据恶性肿瘤患者或家属需求,协助联系院内、外相关医疗照护资源,确保患者接受后续追踪治疗,担任与其他医疗团队成员之间沟通协调管道,协助解决恶性肿瘤患者与家属需求问题。对于肿瘤个案资料管进行管理,定期提供多专科团队个案管理指标结果。
(三)明确各医疗机构的功能定位
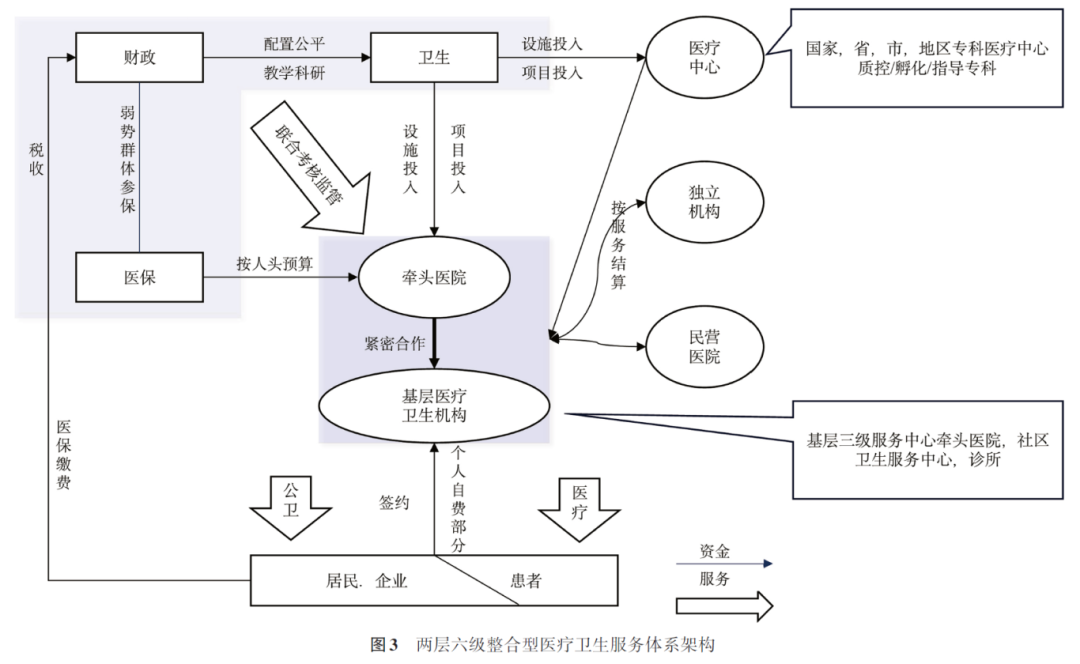
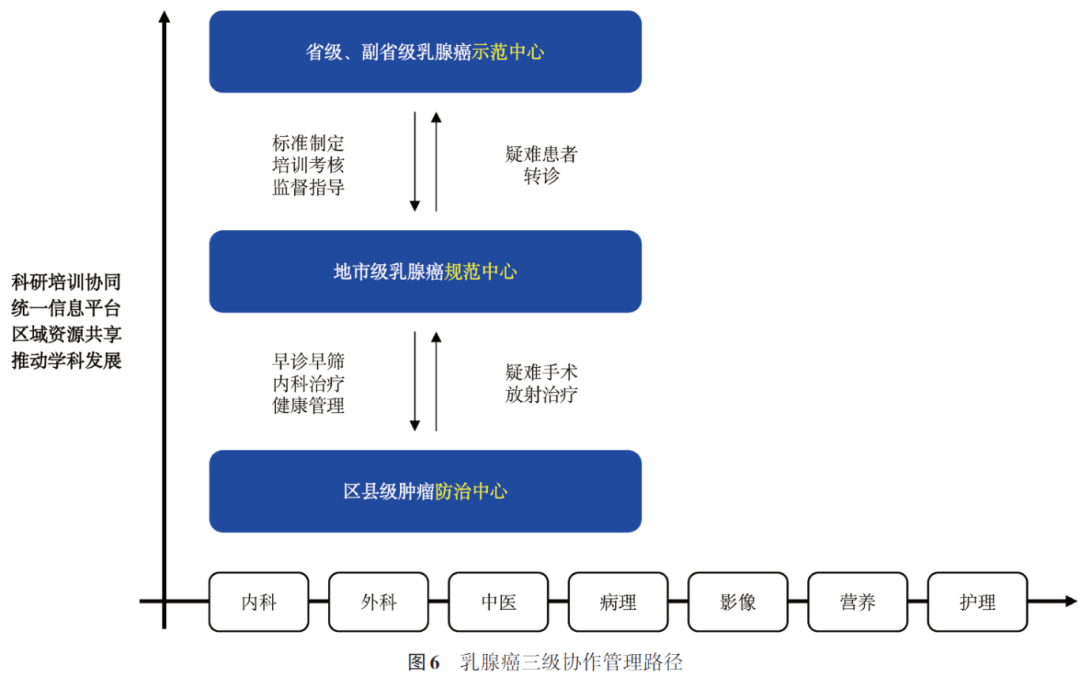
面向中国人口老龄化和慢病为主的健康需求变化,结合分级诊疗体系构建和紧密型医联体政策要求,我国将逐步构建“两层六级”的整合型服务体系架构:两层是指“医疗中心”和“健康管理平台”,六级是指医疗中心和健康管理平台分别包含3个级别。医疗中心的3个级别是国家级、省级和地市级专科医疗中心,其核心功能是解决疑难重症,承担专科领域中质控、孵化、技术引领和技术创新等任务。健康管理平台由牵头医院和基层医疗卫生机构构成,3个级别包括县(区)医院、乡镇卫生院/社区卫生服务中心、村卫生室/社区卫生服务站。各医疗机构将形成以国家级示范中心和国家级、省级区域示范中心为骨干,高水平市级和先进县级规范中心为支点,紧密型城市医疗集团和县域医共体防治中心为载体的高水平公立医院网络,在疑难疾病、重大疾病、重大疫情的医疗救治、多中心研究、大数据集成、科研成果转化等方面发挥协同作用,带动城乡医疗服务体系实现高质量发展(图3)。
1. 乳腺癌示范中心功能定位:乳腺癌专病示范中心承担着对疑难杂症、伴随基础疾病多、复发风险高乳腺癌患者的诊疗责任,以及开展临床研究工作。同时,示范中心将为规范中心和防治中心的卫生机构提供专业技术指导及业务能力培训,致力于在医学科学、技术创新和人才培养等领域发挥引领作用。逐步优化门诊结构,减少常见病、多发病的复诊以及病情稳定、诊断明确的慢性病普通门诊,合理分流慢性病患者,以提升医疗服务效率和质量。
2. 乳腺癌规范中心功能定位:二级及以上医院建立区域规范中心,负责疾病临床诊断,按照疾病诊疗指南、规范制定个体化、规范化、精准化的治疗方案;实施专科体检,并发症治疗(如血栓、术后出血、皮瓣坏死等);指导、实施双向转诊;定期对基层医疗卫生机构医疗质量和医疗效果进行评估。其中,部分有能力的二级医院可负责诊断较明确、难度与风险较低的乳腺癌患者的诊疗工作,在保障医疗质量与安全的基础上,开展乳腺癌手术、放疗、化疗、靶向治疗、内分泌治疗、免疫治疗、临床研究等工作,并根据自身技术能力提供诊疗服务或转诊,对基层医疗卫生机构进行技术指导和业务培训。
3. 肿瘤防治中心功能定位:基层医疗卫生机构作为县域肿瘤防治中心的核心,承担着为确诊的稳定期及康复期患者提供专业的康复和护理服务。遵循疾病诊疗指南和规范,紧密配合上级医院,做好患者的随访和病情监测工作,确保上级医院制定的治疗方案得到有效执行。同时,防治中心致力于建立健全的健康档案和专病档案,确保信息报告的准确性;定期为患者进行常规体检,并在条件允许的情况下开展并发症筛查。此外,防治中心积极开展患者随访、基本治疗及康复治疗工作,普及健康教育,引导患者提升健康素养,科学地进行全病程健康管理。在此基础上,防治中心还将实施双向转诊,确保患者得到最适宜的医疗服务。
(四)提升乳腺癌规范化诊疗能力
1. 明确各层级医疗机构的服务流程
加强和规范顶层设计,一是强基层以完善基层首诊的相关制度基础,建立个案管理师制度、远程医疗制度等,够条件各级医疗机构之间协作的工作机制,推动健全双向转诊和上下联动的相关制度。二是规范专病联盟的医联体建设,推广远程医疗服务,增强县级医院的综合服务能力。
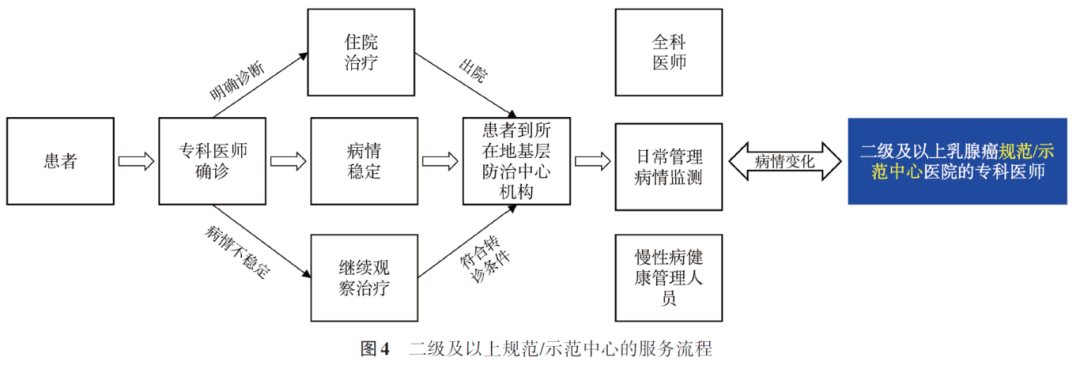
(1)基层医疗防治中心为诊断明确、病情稳定的疾病稳定期患者、康复期患者提供服务
①服务流程:接诊患者并进行初步诊断或接诊下转患者进行病情评估→在诊疗能力范围内的,为患者制定诊疗服务方案→判断是否能够纳入分级诊疗服务→对可以纳入分级诊疗服务的,经患者知情同意后→建立专病档案→开展病情随访、连续性治疗、体检、健康管理。
②上转患者流程:专科医师判断患者符合转诊标准→转诊前与患者和/或家属充分沟通→根据患者病情确定上转医院层级→联系二级及以上规范/示范中心医院→二级及以上规范/示范中心医院专科医师确定患者确需上转→专科医师开具转诊单或通过信息平台与上转医院共享患者相关信息→将患者上转至规范/示范中心医院。
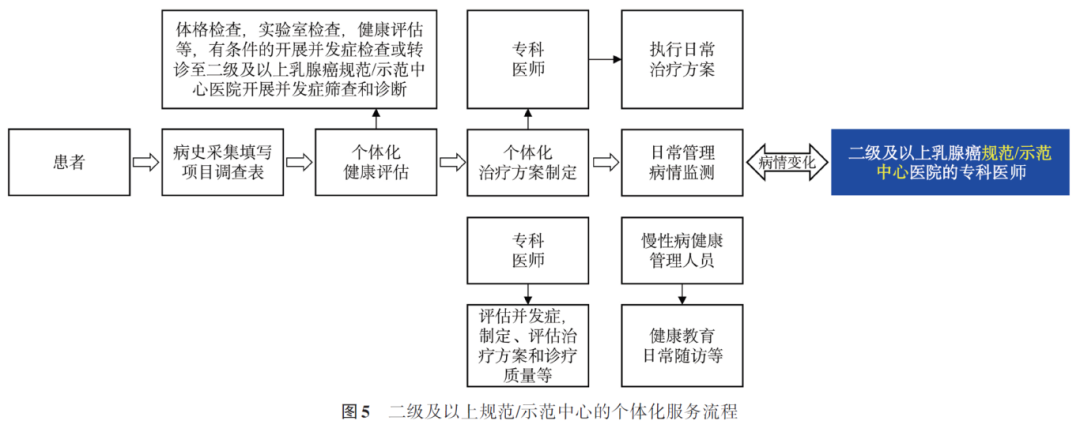
(2)二级及以上规范/示范中心为乳腺癌患者提供手术和放化疗等医疗服务
①初诊患者流程:接诊患者并进行诊断→通过多学科诊疗(multi-disciplinary treatment, MDT)讨论制定治疗方案→给予患者积极治疗(手术和放化疗等治疗)→患者病情稳定,判断是否能够纳入分级诊疗服务→可以纳入分级诊疗服务的患者转至基层就诊→定期派专科医师到基层医疗防治中心机构巡诊、出诊,对分级诊疗服务质量进行评估。
②接诊上转患者及下转流程:接诊患者并进行诊断→MDT讨论制定治疗方案(手术和放化疗等治疗)→患者经治疗稳定、符合下转标准→转诊前与患者和/或家属充分沟通→联系基层医疗卫生机构→专科医师开具转诊单或通过信息平台与下转医院共享患者相关信息→将患者下转至基层医疗防治中心机构(图4、5)。
2. 提高三医协同医疗服务能力
统筹医疗、医保、医药的运行机制和治理主体的行动策略,健全乳腺癌的分级诊疗体制,以提升乳腺癌的综合服务能力。在乳腺癌中,建立以单病种付费为主,按人头付费、按服务单元打包付费等复合型付费方式。打破乳腺癌全流程诊疗管理过程中各层级医疗机构的医保支付差异化制度政策,对符合分级诊疗的转诊门诊和住院患者可以连续累积计算起付线,促进患者分级有序流动。
合理制定和调整医疗服务价格,对于乳腺癌在全流程诊疗管理过程中的基本用药和创新药物进行各层级医疗机构的统一配备和区域内协调,并且对于患者个体化需求药物开启绿色通道,完善药物管理运行机制,以确保转诊患者诊疗方案的规范性。
上级医院对转诊患者提供优先接诊、优先检查、优先住院等服务,鼓励上级医院出具药物治疗方案及其实施细则,在下级医院或基层医疗卫生机构实施治疗和管理。通过医疗机构的双向转诊原则、药物配备的统一性原则、医保的复合型及连续计算性原则,实现各层级医疗机构之间的顺畅转诊。
3. 加强信息化建设实现智慧转诊
通过信息化建设,构建了覆盖各层级医疗机构和各中心的分工协作机制,打造互联互通的肿瘤中心平台网络。通过省级全民肿瘤健康信息平台持续完善,实现各层级肿瘤中心平台的全面联通。建立肿瘤患者的电子档案、电子病历和基础资源数据库,加强医疗服务、医疗保障、药品供应等应用系统的数据集成和业务协同。
基于信息化互联互通平台,充分利用大数据分析和人工智能技术,构建智慧转诊系统,打造数智化的全程管理平台。这一平台将推动了跨层级、跨部门的联动与协同,实现个案管理的上下互通与转接,为各级医疗机构提供了精准的诊疗决策支持,构建肿瘤信息化患者服务网络。
为了实现智慧转诊,未来将着重加强数据集的建设,这是实现信息共享和资源整合的关键基础。通过建立全面、准确、及时的医疗健康数据集,为医疗机构提供科学的决策依据,为患者提供个性化且连续的医疗服务,将显著提升转诊效率和精准度,助力智慧转诊信息化建设。
(1)数据集构成要素:乳腺癌标准数据集应涵盖患者基本信息,包括年龄、性别、出生日期、民族、婚姻状况、联系方式、家庭住址、医保类型、月经及孕产史等;病史信息,如既往疾病史(高血压、冠心病、糖尿病、甲状腺疾病等)、手术史、过敏史等;家族史,包含家族成员的乳腺癌及其他相关疾病发病情况。诊疗信息方面,涵盖筛查结果(乳腺超声、乳腺X线、乳腺 MRI 等检查报告)、诊断报告(临床诊断、病理诊断、分子分型诊断等)、治疗方案(手术方式、化疗方案、放疗方案、内分泌治疗方案、靶向治疗方案等)、手术记录(手术时间、手术名称、手术过程、术中所见等)、放化疗数据(化疗周期、化疗药物剂量、放疗剂量、放疗部位等)。康复信息包括康复计划(康复训练内容、康复时间安排等)、康复评估(康复效果评估指标、评估时间等)、并发症情况(并发症类型、发生时间、治疗情况等)以及随访信息(随访时间、随访方式、随访结果等)。这些信息涵盖了乳腺癌患者的全方位数据,从基本信息到随访信息,确保了数据的全面性和系统性。
(2)数据采集、存储、传输和使用规范:数据采集应遵循标准化流程,确保数据的准确性和完整性。各级医疗机构在采集数据时,应使用统一的数据采集表格和规范的术语。数据存储应采用安全可靠的存储方式,建立数据备份机制,防止数据丢失。数据传输需遵循严格的加密和安全传输协议,确保数据在传输过程中的安全性。在数据使用方面,应建立严格的数据访问权限管理制度,只有经过授权的人员才能访问和使用数据,同时要保护患者的隐私,确保数据的合法合规使用。
(3)建立动态更新机制:为适应医学研究发展和诊疗技术进步,数据集应建立动态更新机制。根据乳腺癌临床研究新成果、新需求,对数据元进行调整。当出现新的乳腺癌诊断技术或治疗方法时,及时添加相关数据元,如新型靶向药物治疗相关的数据元,确保数据集时效性和实用性。
(4)增强数据的可扩展性:考虑到未来研究和诊疗的多样性,为数据元设置可扩展字段。在“其他性激素暴露史情况”数据元中,预留可扩展空间,方便记录新发现的性激素暴露情况,确保数据集能适应不断变化的研究和临床实践需求。通过设置可扩展字段,增强了数据的可扩展性,以适应未来研究和诊疗的多样性。
目前,我国已成功建立了国家抗肿瘤药物临床应用监测平台,这是中国最大的肿瘤诊疗数据集。该数据集覆盖我国31个省(自治区、直辖市),1427家医院,自2013年至今,已包含870种药物,约1500万例患者的全病程信息,其中80%的患者可以评估总生存情况,为我国的肿瘤防治工作提供了精准的数据支持。
4. 三级协作网络提升重大慢病管理能力
以信息化为基础构建三层级肿瘤中心的“省市县”协作网,建立“省级牵头单位+区域诊疗中心+县域医共体区域辐射”诊疗体系,构建多中心、全样本、队列临床研究的协同机制,落实重大慢病-乳腺癌的全周期管理。
三级协作网以“健康中国”发展战略的健康预期寿命为结果指标,聚焦于重大慢病-乳腺癌规范管理率(短期)、重大慢病-乳腺癌有效生存率(长期)为过程指标,通过分析区域内住院率、基层门急诊人次占比、体系医疗服务性收入占比、医保收支结余率等指标进行整体的测算,以落实“健康中国2030”的伟大目标(图6)。
(五)以患者为中心的乳腺癌分级诊疗服务目标、实现路径与双向转诊标准
1. 服务目标
充分发挥乳腺癌单病种三层级中心的作用,通过普及乳腺癌防治知识、提高乳腺癌早期诊断比例、规范乳腺癌诊断治疗方法、发挥基层医院在乳腺癌防治方面的作用、强化乳腺癌治疗患者的终身管理等方法,提高乳腺癌患者生存率,改善乳腺癌患者生活质量。
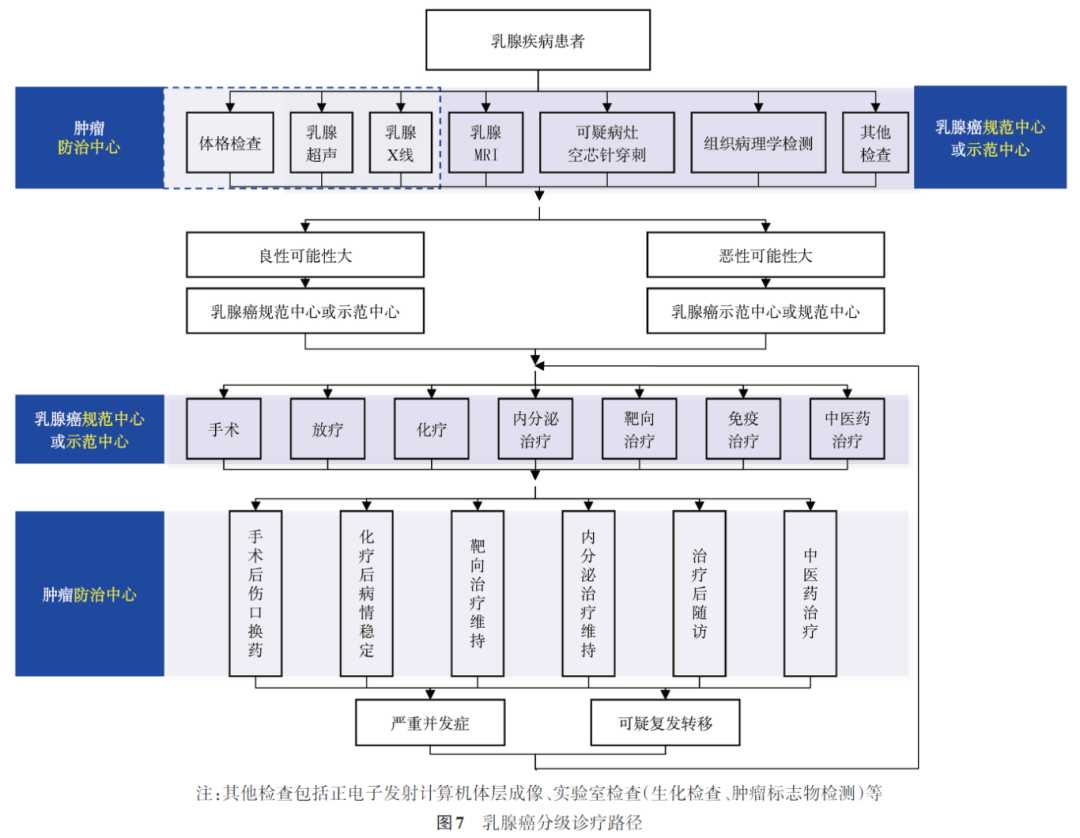
2. 实现路径
实现路径见图7。
3. 双向转诊标准
(1)上转至规范/示范中心医院的标准:社区初诊的乳腺疾病患者,如有以下情况之一:①临床和影像学检查提示为良性乳腺病变,有手术指征的、治疗较为复杂的,或需要和恶性疾病相鉴别;②临床和影像学检查提示为乳腺疾病,无法判断良恶性;③临床和影像学检查提示为恶性乳腺疾病;④基层医院不具备病理诊断条件的,病理难以确诊的患者。在社区随访的乳腺癌患者,如有以下情况之一:①术后换药患者,出现病情变化;②术前或术后化疗患者,出现严重并发症;③术后放疗患者,出现严重并发症;④术后内分泌治疗的患者,出现严重并发症;⑤怀疑肿瘤复发转移;⑥其他无法处理的情况。
(2)上转至乳腺癌示范中心医院的标准:①乳腺肿物临床检查高度怀疑乳腺癌或者诊断不清;②乳头血性溢液;③超声或者乳腺X线检查乳腺影像报告及数据系统(Breast Imaging Reporting and Data System, BI-RADS)分级4B及以上或超声发现可疑淋巴结(如皮质局限增厚、淋巴门消失等);④乳腺癌治疗期间出现严重并发症;⑤怀疑肿瘤复发转移;⑥治疗期间疾病进展,需要调整治疗方案;⑦经综合治疗2~4周后,症状未明显改善者;⑧其他无法处理的情况。
(3)乳腺癌示范中心医院治疗后,下转至乳腺癌规范中心医院的标准:①手术后伤口换药;②伤口或者肿瘤破溃、需要长期换药的患者;③乳腺癌患者治疗后康复;④治疗后随访;⑤化疗用药间隔期内,出现中度以下不良反应的;⑥内分泌治疗、免疫治疗或靶向治疗期内,出现中度以下不良反应的;⑦放疗后胸壁或者乳腺皮肤反应;⑧其他病情较轻,需要住院观察的患者。
(4)下转至基层肿瘤防治中心机构的标准:①治疗(手术、放疗、化疗)结束,病情稳定,没有疾病危重征象;②经综合治疗后,病情稳定,需完成简单康复治疗者。
4. 专科转诊标准
乳腺癌诊疗涉及外科、内科、放射科、病理科、影像科、超声科、精神卫生科等多个学科协作。为优化医疗资源配置、提高诊疗效率及患者生存质量,需建立规范化的专科分级转诊机制。参考《中国县域乳腺癌防治管理路径与质量控制指南(2023版)》,相关专科转诊标准细则如下。
(1)外科:基层防治中心缺乏开展保乳手术、乳房重建等高难度术式的能力,而规范/示范中心通常具有更全面的技术及更完善的设备。是否转诊根据手术级别、医院级别、技术条件、设备设施条件决定。
(2)内科:基层防治中心通常诊断手段较为单一,新型治疗药物不可及。是否转诊根据临床分期、疾病发展、患者意愿等多方面进行决定。
(3)放射科:基层防治中心缺乏开展高级别放疗技术的能力,且部分基层防治中心甚至可能缺乏放射科的设置。是否转诊根据技术条件、设施设备条件、患者意愿等进行决定。
(4)病理科:基层防治中心病理科的发展相对滞后,必要时可将肿瘤样本送至乳腺癌示范/规范中心病理科,也可开展远程病理会诊,力求获得准确的组织病理结果和分子特征以指导治疗。
(5)影像科:若基层防治中心缺乏影像学检查设备或阅片技术,或遇到疑难杂症,可将患者上转或远程会诊。
(6)超声科:若基层防治中心缺乏超声检查经验,无法判断良恶性,或遇到疑难病例,可将患者上转或远程会诊。同时,基层医院若无法完成超声引导下穿刺活检,可将患者转诊至上级医院。
(7)精神卫生科:若基层防治中心缺乏足够经验的精神医师,无法为患者评估精神状态、心理干预等,必可将患者上转或远程会诊。
5. 推动便捷诊疗模式在分级诊疗中的应用
参考《以患者为中心的肿瘤创新诊疗模式中国专家共识》定义,便捷诊疗是指具有资质的医疗机构/工作人员,在多种场景里,出于方便患者的目的,优化就医程序、缩短就医流程、快速提供医疗和护理服务的各种诊疗活动,是以患者为中心的肿瘤创新诊疗模式的重要组成部分。其主要有以下几种形式:日间诊疗中心(包括日间门诊、日间手术、日间病房等)、输注中心(院内和院外)等。
日间诊疗具有“短平快”的特点,使有限的医疗资源得到优化利用,在一定程度上缩短了患者的住院天数,减少了患者的医疗开支,同时也提高了医院的床位使用率,进一步解决患者“住院难”的问题,从而达到医患双赢的目的。
部分使用特殊药品的患者可以到有资质的私营诊所或直接面向患者的社区输注中心进行输液或注射,这种模式可以优化患者用药程序、缩短整体时间、降低经济成本。在日间输注中心,患者无需办理住院手续就能获得医院的专业输注配套应急服务,输注结束、观察完毕后就可以回家休息。
此外,药物剂型的发展也为便捷诊疗的开展提供了前提条件。相较于长期静脉输注,皮下注射制剂的研发与推广,使患者有机会在更短的时间内接受更便捷的给药方式,将减少并发症风险,降低对医疗资源的依赖,极大地提高了肿瘤患者的治疗满意度。而固定剂量的给药方式无需根据患者体重计算给药,对降低院感风险、提升用药安全水平具有重要意义,更简单的操作也降低了靶向药物使用门槛,助力分级诊疗下的标准化治疗,提升同质化分级诊疗水平。
1. 乳腺癌的预防:乳腺癌的预防工作共分为三级。一级预防即病因预防,通过控制病因或危险因素预防乳腺癌的发生,是最积极、最根本的预防手段。二级预防是指早发现、早诊断及早治疗,其目标是尽早发现疾病线索,防止或延缓疾病的发展和恶化,提高治愈率及生存率。三级预防即康复预防,主要为确诊患者提供各种治疗手段,提高生存率及康复率,包括防止肿瘤复发、转移,减少术后疼痛及其他并发症等。关于具体预防细则建议参照相关专家共识。
2. 乳腺癌的筛查:乳腺癌筛查是通过有效、简便、经济的乳腺检查措施,对无症状女性开展筛查,以期早期发现、早期诊断及早期治疗,其最终目的是要降低人群乳腺癌的死亡率。筛查的方式包括乳腺X线、超声,必要时联合MRI。由于X线对致密型乳腺的穿透性较弱,基于东方女性乳房的特点,超声可以作为筛查的常规方案。MRI准确性高,但价格昂贵,可以作为乳腺X线和超声的补充检查。具体筛查细则可参照相关指南或专家共识。
3. 乳腺癌的诊断:主要包括病史采集、体格检查、实验室检查、靶器官损害表现以及分子分型诊断等。但乳腺癌的确诊需要病理学诊断。可以通过穿刺活检或切除活检等方式获得组织学标本(在有条件的医院首先推荐穿刺活检),应告知可疑乳腺癌患者,具体诊断细则参照相关指南。
4. 乳腺癌的治疗:乳腺癌的治疗方案包括手术、放疗、化疗、靶向治疗、内分泌治疗、免疫治疗和中医中药治疗等,告知乳腺癌患者规范的治疗方案,树立治疗信心,以期将乳腺癌变成可以控制的慢性病。具体治疗方案参照相关指南。
5. 乳腺癌治疗后的康复管理:乳腺癌患者的康复管理包括生理功能的康复、心理社会功能的恢复。乳腺癌的康复治疗就是在乳腺癌正规治疗的同时或结束后,帮助患者恢复机体生理功能、调整心理状态,并且能够回归社会正常生活的所有干预手段。具体康复管理细则参照相关指南。
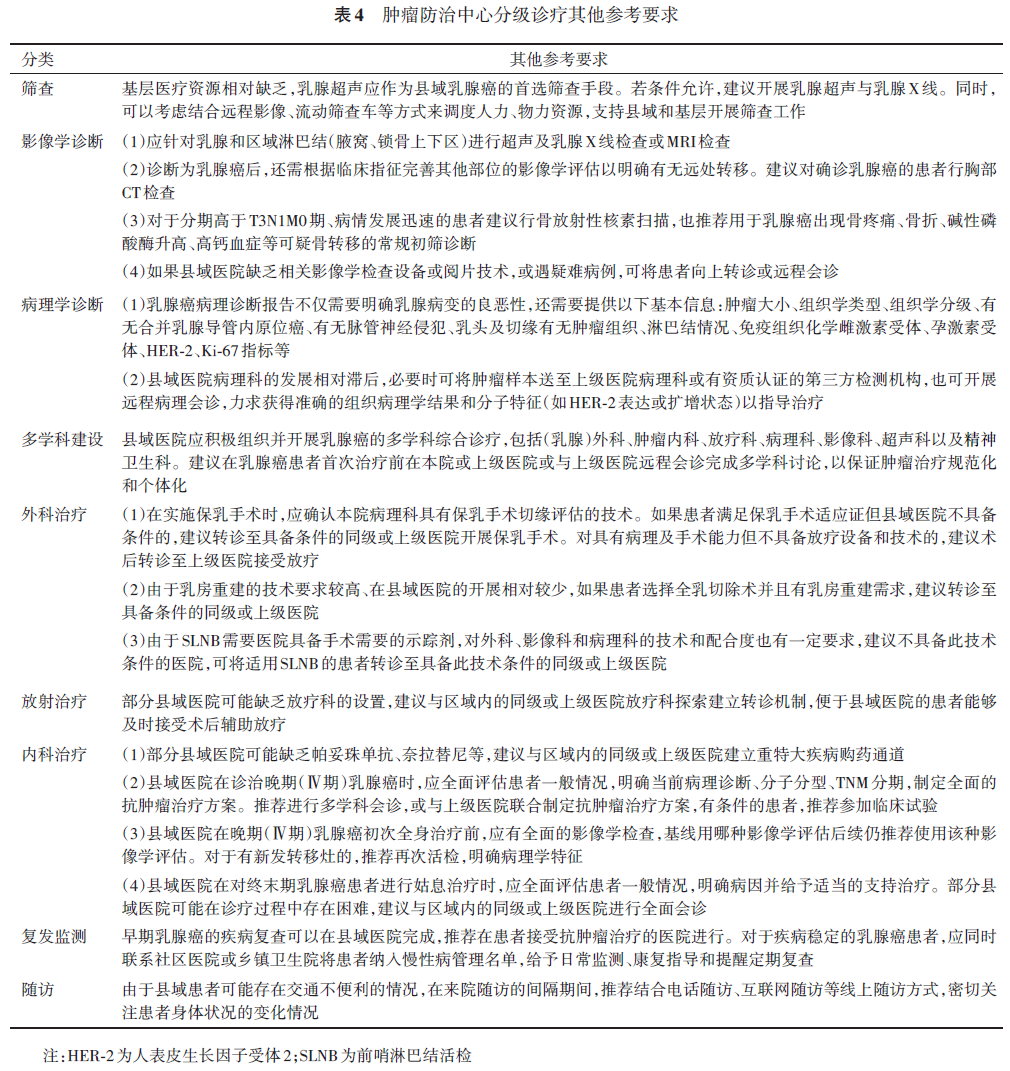
6. 乳腺癌单病种分级诊疗层级评估指标:为了了解乳腺癌规范化诊疗临床实践指南的落实情况,进一步推动乳腺癌规范化诊疗质量控制工作,我国已逐步完善乳腺癌质控指标体系。本共识主要参考《中国乳腺癌规范诊疗质量控制指标(2022版)》、《肿瘤专业医疗质量控制指标(2023版)》、《国家三级公立医院绩效考核操作手册(2024版)》、《中国乳腺癌规范诊疗质量控制年鉴(2024)》以及《中国县域乳腺癌防治管理路径与质量控制指南(2023版)》。为各层级医院制定不同的评估指标,见表1~4。具体各指标详情见附录1、2、3。


附录1 乳腺癌示范中心分级诊疗评估指标
一、管理指标
1. 乳腺癌手术患者并发症发生率
定义:乳腺癌手术患者发生并发症例数占同期出院的乳腺癌手术患者例数的比例。
计算公式:乳腺癌手术患者并发症发生率=∑乳腺癌手术患者并发症发生例数/∑同期出院的乳腺癌手术患者例数×100%。
意义:衡量乳腺癌手术相关的医疗技术能力和管理水平。
说明:行姑息切除术的患者除外。
2. 乳腺癌Ⅰ类切口手术部位感染率
定义:乳腺癌患者发生Ⅰ类切口手术部位感染例数占同期乳腺癌手术Ⅰ类切口手术例数的比例。
计算公式:乳腺癌Ⅰ类切口手术部位感染率=∑乳腺癌手术Ⅰ类切口手术部位感染例数/∑同期乳腺癌手术Ⅰ类切口手术例数×100%。
意义:反映医院对接受Ⅰ类切口手术的患者医院感染管理和防控情况。
说明:病案首页切口愈合等级为“丙级愈合”,纳入“Ⅰ类切口手术部位感染例数”。
3. 乳腺癌患者非计划二次手术率
定义:乳腺癌患者非计划二次手术例数占同期乳腺癌患者手术例数的比例。
计算公式:乳腺癌患者非计划二次手术率=∑乳腺癌患者非计划二次手术例数/∑同期乳腺癌患者手术例数×100%。
意义:反映医疗技术能力和医疗质量。
说明:非计划二次手术指本次住院期间二次同一部位手术,手术原因为出血、切口感染、切口裂开等。
4. 乳腺癌患者低风险组病例死亡率
定义:乳腺癌患者采用疾病诊断相关分组(DRGs)分组器测算产生低风险组患者,其死亡率是指该组死亡的病例数占低风险组全部病例数量的比例。
计算公式:乳腺癌患者低风险组病例死亡率=∑乳腺癌患者低风险组死亡例数/∑乳腺癌患者低风险组病例数×100%。
意义:衡量医院对住院患者所提供服务的安全和质量。
说明:低风险组患者的死亡率低于-1倍标准差,其死亡风险则称为低风险的DRG组,即一旦发生死亡,死亡原因可能与疾病本身的相关度低,而与临床诊治管理过程相关度高。
二、诊断部分
1. 乳腺癌患者首次治疗前临床TNM分期评估率
(1)乳腺癌患者首次治疗前完成临床TNM分期诊断率
定义:乳腺癌患者首次治疗前完成临床TNM分期诊断的病例数占同期接受首次治疗的乳腺癌患者病例数的比例。
计算公式:乳腺癌患者首次治疗前完成临床TNM分期诊断率=∑乳腺癌患者首次治疗前完成临床TNM分期诊断的病例数/∑同期接受首次治疗的乳腺癌患者病例数×100%。
意义:治疗前全面评估病情,是肿瘤规范化治疗的基础。
说明:TNM分期诊断一般需在首次治疗前30 d内完成。
(2)乳腺癌患者首次治疗前完成临床TNM分期检查评估率
定义:乳腺癌患者首次治疗前完成临床TNM分期检查评估的病例数占同期接受首次治疗的乳腺癌患者病例数的比例。
计算公式:乳腺癌患者首次治疗前完成临床TNM分期检查评估率=∑乳腺癌患者首次治疗前完成临床TNM分期检查评估的病例数/∑同期接受首次治疗的乳腺癌患者病例数×100%。
意义:治疗前全面评估病情,是肿瘤规范化治疗的基础。
说明:临床TNM分期检查符合基本策略1或符合基本策略2。基本策略1:乳腺超声或乳腺X线(钼靶)或乳腺MRI+胸部CT+腹部超声(或腹部CT或腹部MRI);基本策略2:乳腺超声或乳腺X线(钼靶)或乳腺MRI+正电子发射计算机断层扫描。TNM分期检查一般需在首次治疗前30 d内完成。
2. 乳腺癌患者抗肿瘤药物治疗前病理学诊断率
定义:乳腺癌患者抗肿瘤药物治疗前完成肿瘤病理学诊断的病例数占同期接受首次抗肿瘤药物治疗的乳腺癌患者病例数的比例。
计算公式:乳腺癌患者抗肿瘤药物治疗前病理学诊断率=∑乳腺癌抗肿瘤药物治疗前完成病理学诊断病例数/∑同期接受首次抗肿瘤药物治疗的乳腺癌患者病例数×100%。
意义:明确病理诊断是肿瘤综合治疗方案选择的基础。
说明:抗肿瘤药物治疗包括化疗、靶向治疗、免疫治疗、内分泌治疗。
3. 乳腺癌患者术后病理报告完整率
定义:乳腺癌患者术后病理报告完整的病例数占同期收治的乳腺癌手术患者病例数的比例。
计算公式:乳腺癌患者术后病理报告完整率=∑乳腺癌术后病理报告完整的病例数/∑同期乳腺癌手术有病理报告的患者病例数×100%。
意义:反映病理诊断报告规范,指导乳腺癌术后辅助治疗。
4. 放射治疗前乳腺癌患者病理学诊断率
定义:放射治疗前明确病理学诊断的乳腺癌患者病例数占同期收治的行放射治疗的乳腺癌患者病例数的比例。
计算公式:放射治疗前乳腺癌患者病理学诊断率=∑放射治疗前明确病理学诊断的乳腺癌患者病例数/∑同期收治行放射治疗的乳腺癌患者病例数×100%。
意义:反映行放射治疗的乳腺癌患者的治疗规范。
5. 乳腺癌患者首次治疗前超声诊断符合率
定义:乳腺癌患者首次治疗前超声诊断为BI-RADS 4类及以上的病例数占病理确诊乳腺癌病例数的比例。
计算公式:乳腺癌患者首次治疗前超声诊断符合率=∑乳腺癌患者首次治疗前超声诊断为BI-RADS 4类及以上的病例数/∑病理确诊乳腺癌患者病例数×100%。
意义:反映超声诊断结论与病理诊断的一致程度,体现乳腺癌超声诊断的规范化,是治疗前评估患者病情的重要参考指标。
说明:乳腺超声检查一般在患者治疗前30 d内。
6. 乳腺癌患者首次治疗前乳腺X线诊断符合率
定义:乳腺癌患者首次治疗前乳腺X线诊断为BI-RADS 4类及以上的病例数占病理确诊乳腺癌病例数的比例。
计算公式:乳腺癌患者首次治疗前乳腺X线诊断符合率=∑乳腺癌患者首次治疗前乳腺X线诊断为BI-RADS 4类及以上的病例数/∑病理确诊乳腺癌患者病例数×100%。
意义:反映乳腺X线诊断结论与病理诊断的一致程度,体现乳腺癌X线诊断的规范化,是治疗前评估患者病情的重要参考指标。
说明:乳腺X线检查一般在患者治疗前30 d内。
三、外科部分
1. 早期乳腺癌患者前哨淋巴结活检手术比例
定义:早期乳腺癌(临床分期为T1~2N0M0)患者开展前哨淋巴结活检手术的病例数占同期收治的早期乳腺癌手术患者病例数的比例。
计算公式:早期乳腺癌患者前哨淋巴结活检手术比例=∑早期乳腺癌患者前哨淋巴结活检手术的病例数/∑同期早期乳腺癌手术患者病例数×100%。
意义:反映临床早期腋窝淋巴结阴性(T1~2N0M0)的患者行前哨淋巴结活检的应用情况。
说明:乳腺癌手术和前哨淋巴结活检手术不一定同期发生。
2. 腋窝淋巴结清扫数量为10枚以上比例
定义:乳腺癌患者术中清扫腋窝淋巴结数量为10枚以上的病例数占乳腺癌患者术中行腋窝淋巴结清扫的病例数的比例。
计算公式:腋窝淋巴结清扫数量为10枚以上比例=∑乳腺癌患者术中清扫腋窝淋巴结数量为10枚以上的病例数/∑乳腺癌患者术中行腋窝淋巴结清扫的病例数×100%。
意义:反映乳腺癌患者术中清扫腋窝淋巴结的规范性。
说明:符合腋窝淋巴结清扫的指征的患者,术中清扫腋窝淋巴结要求在10枚以上,以保证能真实地反映腋窝淋巴结的状况。
四、放疗
1. 乳腺癌患者保乳术后放疗比例
定义:乳腺癌患者保乳术后实际接受放疗的病例数占收治的乳腺癌患者保乳手术后应放疗病例数的比例。
计算公式:乳腺癌患者保乳术后放疗比例=∑乳腺癌患者保乳术后实际接受放疗的病例数/∑收治的乳腺癌患者保乳手术后应放疗病例数×100%。
意义:反映乳腺癌患者保乳术后治疗的规范性。
说明:如患者术后未进行辅助化疗,放疗一般需在术后60 d内进行。如患者术后接受辅助化疗,放疗一般需在末次化疗结束后60 d内进行。不论患者是否接受辅助化疗,放疗一般需在术后半年内进行。
2. 乳腺癌改良根治术后患者的放疗比例
定义:乳腺癌改良根治术后T3~4或淋巴结转移个数≥4枚的患者中实际接受放疗的病例数占收治的乳腺癌改良根治术后T3~4或淋巴结转移个数≥4枚的患者应接受放疗的病例数的比例。
计算公式:乳腺癌改良根治术后患者的放疗比例=∑改良根治术后T3~4或淋巴结转移个数≥4枚患者中实际接受放疗的病例数/∑乳腺癌改良根治术后T3~4或淋巴结转移个数≥4枚患者应接受放疗的病例数×100%。
意义:反映乳腺癌改良根治术后患者的治疗规范。
3. 乳腺癌放疗记录规范率
定义:记录了放疗技术、靶区定义、放疗剂量的乳腺癌人次数占同期收治行放疗的乳腺癌人次数的比例。
计算公式:乳腺癌放疗记录规范率=∑记录了放疗技术、放疗靶区、放疗剂量的乳腺癌人次数/∑同期乳腺癌放疗患者人次数×100%。
意义:放疗技术、靶区定义和照射剂量为放射治疗的关键指标,体现乳腺癌治疗规范化,也是评估患者再放疗可能性及放疗并发症的重要参考指标。
五、药物治疗
1. 临床分期为Ⅲ期的乳腺癌患者术前新辅助治疗比例
定义:临床分期为Ⅲ期(不含T3N1M0)的乳腺癌手术患者术前行新辅助治疗的病例数占同期收治的临床分期为Ⅲ期(不含T3N1M0)乳腺癌手术患者病例数的比例。
计算公式:临床分期为Ⅲ期的乳腺癌患者术前新辅助治疗比例=∑临床分期为Ⅲ期(不含T3N1M0)患者术前行新辅助治疗的病例数/∑同期临床分期为Ⅲ期(不含T3N1M0)乳腺癌手术患者病例数×100%。
意义:反映局部晚期乳腺癌患者的治疗规范。
说明:如患者接受术前新辅助治疗,其末次治疗距离手术一般不超过30 d。
2. 乳腺癌患者化疗记录规范率
定义:记录了化疗方案、化疗药物剂量、化疗时间的乳腺癌人次数占同期收治的乳腺癌化疗患者人次数的比例。
计算公式:乳腺癌患者化疗记录规范率=∑记录了化疗方案、化疗剂量、化疗时间的乳腺癌人次数/∑同期乳腺癌化疗患者人次数×100%。
意义:化疗方案、化疗药物剂量为化疗的关键指标,是评估患者治疗规范性及制定后续治疗方案的重要参考指标。
说明:术后辅助化疗开始时间一般在术后60 d内。
3. 晚期转移性(临床分期为M1)乳腺癌患者首次治疗选择全身系统性治疗比例
定义:晚期转移性乳腺癌患者首次治疗选择全身系统性治疗的病例数占同期收治的首次治疗晚期转移性乳腺癌患者病例数的比例。
计算公式:晚期转移性(临床分期为M1)乳腺癌患者首次治疗选择全身系统性治疗比例=∑晚期转移性乳腺癌患者首次治疗选择全身系统性治疗的病例数/∑同期首次治疗晚期转移性乳腺癌患者病例数×100%。
意义:反映晚期乳腺癌的治疗规范。
4. 乳腺癌术后激素受体阳性患者接受辅助内分泌治疗比例
定义:乳腺癌术后激素受体阳性患者中实际接受内分泌治疗的病例数占同期收治的乳腺癌术后激素受体阳性患者应接受内分泌治疗病例数的比例。
计算公式:乳腺癌术后激素受体阳性患者接受辅助内分泌治疗比例=∑乳腺癌术后激素受体阳性患者中接受内分泌治疗病例数/∑同期乳腺癌术后激素受体阳性患者病例数×100%。
意义:反映乳腺癌术后治疗规范。
说明:雌激素受体(estrogen receptor, ER)≥1%阳性和(或)孕激素受体(progesterone receptor, PR)≥1%阳性。如患者未接受辅助化疗,内分泌治疗一般在术后30 d内开始,最晚不超过60 d。如患者接受了辅助化疗,内分泌治疗一般在化疗结束后30 d内开始,最晚不超过60 d。
5. 乳腺癌术后人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)阳性患者中接受针对性靶向治疗比例
定义:乳腺癌术后HER-2阳性且原发灶最大径≥l cm或淋巴结阳性乳腺癌患者中实际接受曲妥珠单抗靶向治疗的病例数占收治的术后HER-2阳性且原发灶最大径≥l cm或淋巴结阳性乳腺癌患者应接受靶向治疗病例数的比例。
计算公式:乳腺癌术后HER-2阳性患者中接受针对性靶向治疗比例=∑术后HER-2阳性且(原发灶长径≥1 cm或淋巴结阳性)乳腺癌患者中半年内实际接受靶向治疗的病例数/∑术后HER-2阳性且(原发灶长径≥1 cm或淋巴结阳性)患者应接受靶向治疗的病例数)×100%。
意义:反映乳腺癌术后治疗规范。
说明:HER-2阳性指免疫组化结果为HER-2(3+)或免疫组化结果为HER-2(2+)且荧光原位杂交(fluorescence in situ hybridization, FISH)阳性。
6. 乳腺癌术后接受辅助内分泌治疗患者激素受体阳性比例
定义:乳腺癌术后激素受体阳性并接受内分泌治疗的病例数占同期收治的乳腺癌术后接受辅助内分泌治疗病例数的比例。
计算公式:乳腺癌术后接受辅助内分泌治疗患者激素受体阳性比例=∑乳腺癌术后激素受体阳性并接受内分泌治疗的病例数/∑同期乳腺癌术后接受辅助内分泌治疗病例数×100%。
意义:反映乳腺癌术后治疗规范。
说明:激素受体阳性指ER≥1%阳性和(或)PR≥1%阳性。
7. 乳腺癌接受抗HER-2靶向治疗患者中HER-2阳性患者比例
定义:乳腺癌HER-2阳性患者接受抗HER-2靶向治疗病例数占同期接受HER-2靶向治疗的乳腺癌病例数的比例。
计算公式:乳腺癌接受抗HER-2靶向治疗患者中HER-2阳性患者比例=∑HER-2阳性患者接受HER-2靶向治疗的病例数/∑同期接受HER-2靶向治疗的乳腺癌病例数×100%。
意义:体现HER-2靶向药物使用是否规范。
说明:HER-2阳性指免疫组化结果为HER-2 (3+)或免疫组化结果为HER-2(2+)且FISH阳性。
六、其他
1. 乳腺癌患者首次治疗前完成MDT比例
定义:乳腺癌患者首次治疗前完成MDT讨论的病例数占同期接受首次治疗的乳腺癌患者病例数的比例。
计算公式:乳腺癌患者首次治疗前完成MDT比例=∑乳腺癌患者首次治疗前完成MDT讨论的病例数/∑同期接受首次治疗的乳腺癌患者病例数×100%。
意义:保证肿瘤治疗规范化和个体化的重要过程性指标。
说明:暂不质控。
2. 乳腺癌患者治疗后随访率
定义:乳腺癌住院患者分别于治疗后第N年内完成随访的病例数占同期治疗的乳腺癌住院患者病例数的比例。
计算公式:乳腺癌患者治疗后随访率=∑乳腺癌患者治疗后第N年完成随访的病例数/∑同期乳腺癌患者病例数×100%。
意义:反映医疗机构治疗乳腺癌患者的长期管理水平,为进一步评价乳腺癌患者结果性质控指标提供评价依据。
说明:暂不质控。
附录2 乳腺癌规范中心分级诊疗评估指标
一、管理指标
乳腺癌Ⅰ类切口手术部位感染率
定义:发生Ⅰ类切口手术部位感染的乳腺癌患者数占乳腺癌Ⅰ类切口手术患者总数的比例。
计算公式:乳腺癌I类切口手术部位感染率=发生Ⅰ类切口手术部位感染的乳腺癌患者数/同期乳腺癌Ⅰ类切口手术患者总数×100%。
意义:反映医院感染管理和防控情况。
说明:病案首页切口愈合等级为“丙级愈合”,纳入“Ⅰ类切口手术部位感染例数”。
二、诊断部分
1. 乳腺癌患者首次治疗前完成临床TNM分期诊断率
定义:首次治疗前完成临床TNM分期诊断的乳腺癌患者数占接受首次治疗的乳腺癌患者总数的比例。
计算公式:乳腺癌患者首次治疗前完成临床TNM分期诊断率=首次治疗前完成临床TNM分期诊断的乳腺癌患者数/同期接受首次治疗的乳腺癌患者总数×100%。
意义:治疗前全面评价病情是肿瘤规范化治疗的基础。
说明:TNM分期诊断一般需在首次治疗前30 d内完成。
2. 乳腺癌患者首次治疗前完成临床TNM分期检查评估策略符合率
定义:首次治疗前临床TNM分期检查评估符合策略的乳腺癌患者数占接受首次治疗的乳腺癌患者总数的比例。
计算公式:乳腺癌患者首次治疗前完成临床TNM分期检查评估策略符合率=首次治疗前临床TNM分期检查评估符合策略的乳腺癌患者数/同期接受首次治疗的乳腺癌患者总数×100%。
意义:反映评估病情的规范性。
说明:临床TNM分期检查评估符合策略是指符合基本策略1或基本策略2。基本策略1:乳腺超声/乳腺X线(钼靶)/乳腺MRI+胸部CT+腹部超声(或CT或MRI);基本策略2:乳腺超声/乳腺X线(钼靶)/乳腺MRI+PET-CT
3. 乳腺癌患者非手术治疗前病理学诊断率
定义:首次非手术治疗前完成病理学诊断的乳腺癌患者数占接受首次非手术治疗的乳腺癌患者总数的比例。
计算公式:乳腺癌患者非手术治疗前病理学诊断率=首次非手术治疗前完成病理学诊断的乳腺癌患者数/同期接受首次非手术治疗的乳腺癌患者总数×100%。
意义:明确病理诊断是肿瘤综合治疗方案选择的基础。
说明:本指标的非手术治疗包括放疗、化疗、靶向治疗、内分泌治疗、免疫治疗等治疗。
三、外科部分
1. 早期乳腺癌患者前哨淋巴结活检率
定义:行前哨淋巴结活检手术的早期乳腺癌患者数占早期乳腺癌手术患者总数的比例。
计算公式:早期乳腺癌患者前哨淋巴结活检率=行前哨淋巴结活检手术的早期乳腺癌患者数/同期早期乳腺癌手术患者总数×100%。
意义:提高腋窝淋巴结清扫术的合理性。
说明:本指标早期乳腺癌指临床分期为T1~2N0M0的乳腺癌。
2. 腋窝淋巴结清扫充分率
定义:清扫腋窝淋巴结数量≥10枚的乳腺癌患者数占行腋窝淋巴结清扫术的乳腺癌患者总数的比例。
计算公式:腋窝淋巴结清扫充分率=清扫腋窝淋巴结数量≥10枚的乳腺癌患者数/同期行腋窝淋巴结清扫术的乳腺癌患者总数×100%。
意义:反映乳腺癌患者术中清扫腋窝淋巴结的规范性。
四、放疗
1. 乳腺癌患者保乳术后放疗率
定义:行术后放疗的乳腺癌保乳术患者数占乳腺癌保乳术患者总数的比例。
计算公式:乳腺癌患者保乳术后放疗率=行术后放疗的乳腺癌保乳术患者数/同期乳腺癌保乳术患者总数×100%。
意义:反映乳腺癌患者保乳术后治疗的规范性。
2. 乳腺癌患者改良根治术后放疗率
定义:乳腺癌改良根治术后行放疗的患者数占乳腺癌改良根治术患者总数的比例。
计算公式:乳腺癌改良根治术后患者放疗率=乳腺癌改良根治术后行放疗的患者数/同期乳腺癌改良根治术患者总数×100%。
意义:反映乳腺癌改良根治术后患者治疗的规范性。
说明:本指标统计范围为改良根治术后病理分期为T3~4或者淋巴结转移≥4枚的乳腺癌患者。
五、药物治疗
1. 局部晚期乳腺癌患者新辅助治疗率
定义:接受新辅助治疗的局部晚期乳腺癌患者数占局部晚期乳腺癌患者总数的比例。
计算公式:局部晚期乳腺癌患者新辅助治疗率=接受新辅助治疗的局部晚期乳腺癌患者数/同期局部晚期乳腺癌患者总数×100%。
意义:反映乳腺癌局部晚期患者治疗的规范性。
说明:本指标的局部晚期乳腺癌指临床分期为Ⅲ期(不含T3N1M0)的乳腺癌,新辅助治疗包含化疗、靶向治疗、内分泌治疗等治疗措施。
2. 晚期转移性乳腺癌患者首次治疗全身系统性治疗率
定义:首次治疗接受全身系统性治疗的晚期转移性乳腺癌患者数占首次治疗的晚期转移性乳腺癌患者总数的比例。
计算公式:晚期转移性乳腺癌患者首次治疗全身系统性治疗率=首次治疗接受全身系统性治疗的晚期转移性乳腺癌患者数/同期首次治疗的晚期转移性乳腺癌患者总数×100%。
意义:反映晚期乳腺癌治疗的规范性。
说明:本指标的晚期转移性乳腺癌患者指临床分期为M1的乳腺癌患者。全身系统性治疗指抗肿瘤药物治疗,包括化疗、靶向治疗、免疫治疗、内分泌治疗。
3. 激素受体阳性乳腺癌患者术后接受辅助内分泌治疗率
定义:术后接受辅助内分泌治疗的激素受体阳性乳腺癌患者数占术后激素受体阳性的乳腺癌患者总数的比例。
计算公式:激素受体阳性乳腺癌患者术后接受辅助内分泌治疗率=术后接受辅助内分泌治疗的激素受体阳性乳腺癌患者数/同期术后激素受体阳性的乳腺癌患者总数×100%。
意义:反映晚期乳腺癌治疗的规范性。
4. 接受抗HER-2靶向治疗的乳腺癌患者中HER-2阳性率
定义:接受抗HER-2靶向治疗且HER-2阳性的乳腺癌患者数占接受抗HER-2靶向治疗的乳腺癌患者总数的比例。
计算公式:接受抗HER-2靶向治疗的乳腺癌患者中HER-2阳性率=接受抗HER-2靶向治疗且HER-2阳性的乳腺癌患者数/同期接受抗HER-2靶向治疗的乳腺癌患者总数×100%。
意义:反映HER-2靶向药物使用的规范性。
附录3 肿瘤防治中心分级诊疗评估指标
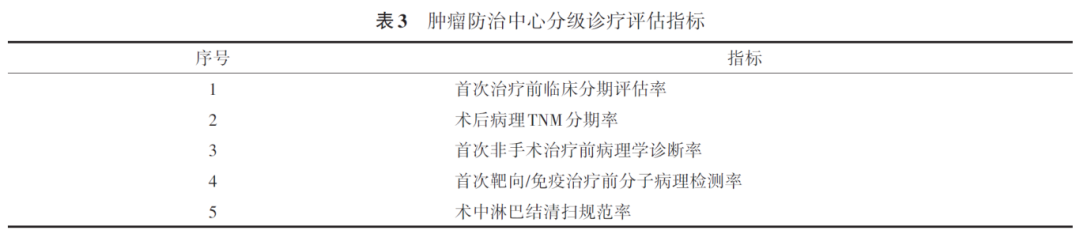
1. 首次治疗前临床分期评估率
定义:考核年度内符合纳入条件的10个癌种(乳腺癌、肺癌、肝癌、宫颈癌、胃癌、结直肠癌、食管癌、甲状腺癌、前列腺癌、肾癌),首次治疗前完成临床分期评估的患者数占同期首次治疗患者数的比例,计量单位:百分比(%)。
计算公式:首次治疗前临床分期评估率=某癌种首次治疗前完成临床分期评估的患者数/同期首次治疗的某癌种患者数×100%。
意义:治疗前全面评估病情,是肿瘤规范化治疗的基础。
说明:TNM分期诊断一般需在首次治疗前30 d内完成。
2. 术后病理TNM分期率
定义:考核年度内符合纳入条件的8个癌种(乳腺癌、肺癌、肝内胆管癌、胃癌、结直肠癌、甲状腺癌、前列腺癌肾癌),术后完成病理TNM分期诊断的患者数占同期手术患者数的比例,计量单位:百分比(%)。
计算公式:术后病理TNM分期率=术后完成病理TMN分期诊断的某癌种患者数/同期手术治疗的某癌种患者数×100%。
意义:治疗前全面评估病情,是肿瘤规范化治疗的基础。
3. 首次非手术治疗前病理学诊断率
定义:考核年度内符合纳入条件的9个癌种(乳腺癌、肺癌、肝内胆管癌、宫颈癌、胃癌、结直肠癌、食管癌、前列腺癌、肾癌),首次非手术治疗前完成病理学诊断的患者数占同期首次非手术治疗患者数的比例,计量单位:百分比(%)。
计算公式:首次非手术治疗前病理学诊断率=首次非手术治疗前完成病理学诊断的某癌种患者数/同期首次非手术治疗的某癌种患者数×100%。
意义:明确病理诊断是肿瘤综合治疗方案选择的基础。
说明:本指标的非手术治疗包括放疗、化疗、靶向治疗、内分泌治疗、免疫治疗等治疗。
4. 首次靶向或免疫治疗前分子病理检测率
定义:考核年度内符合纳入条件的4个癌种(乳腺癌、肺癌、胃癌、结直肠癌),首次靶向或免疫治疗前完成分子病理检测的患者数占同期首次靶向或免疫治疗患者数的比例,计量单位:百分比(%)。
计算公式:首次靶向或免疫治疗前分子病理检测率=首次靶向或免疫治疗前完成分子病理检测的某癌种患者数/同期首次靶向或免疫治疗的某癌种患者数×100%。
意义:进一步加强医疗质量管理,规范临床诊疗行为,促进医疗服务的标准化、同质化。
5. 术中淋巴结清扫规范率
定义:考核年度内符合纳入条件的5个癌种(乳腺癌、肺癌、肝癌、结直肠癌、食管癌),术中淋巴结清扫数量符合要求的患者数占同期接受淋巴结清扫术患者数的比例,计量单位:百分比(%)。
计算公式:术中淋巴结清扫规范率=规范完成术中淋巴结清扫数量的某癌种患者数/同期接受淋巴结清扫术的某癌种患者数×100%。
意义:加强医疗质量管理,规范临床诊疗行为,促进医疗服务的标准化、同质化。
专家名单
执笔专家
王佳妮(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
王书平(国家卫生健康委卫生与发展研究中心)
黄二丹(国家卫生健康委卫生与发展研究中心)
马飞(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
顾问专家
徐兵河(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
编写组成员(按姓氏汉语拼音字母排序)
白晓蓉(甘肃省肿瘤医院乳腺外科)
陈前军(广东省中医院中医外科)
陈茹(海南省人民医院乳腺外科)
陈文林(云南省肿瘤医院乳腺外科)
陈文艳(南昌市人民医院肿瘤内科)
邓淼(河南科技大学第一附属医院外科)
范照青(北京大学肿瘤医院乳腺外科)
耿翠芝(河北医科大学第四医院乳腺外科)
顾雅佳(复旦大学附属肿瘤医院影像科)
郭晓静(天津医科大学肿瘤医院病理科)
韩兴华(中国科学技术大学附属第一医院肿瘤内科)
何文博(定州市人民医院外科)
胡夕春(复旦大学附属肿瘤医院乳腺内科)
黄建(浙江大学医学院附属第二医院乳腺外科)
贾红燕(山西医科大学第一医院乳腺外科)
金锋(中国医科大学附属第一医院乳腺外科)
厉红元(重庆医科大学附属第一医院乳腺外科)
李卉(四川省肿瘤医院乳腺外科)
李静(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院影像诊断科)
李金平(宁夏医科大学总医院肿瘤外科)
李曼(大连医科大学第二医院肿瘤内科)
刘健(福建省肿瘤医院肿瘤内科)
刘德权(云南省肿瘤医院乳腺外科)
刘洪(大理白族自治州人民医院外科)
刘蜀(贵州医科大学附属医院乳腺外科)
刘通(哈尔滨医科大学附属肿瘤医院乳腺外科)
刘新兰(宁夏医科大学总医院肿瘤内科)
刘月平(河北医科大学第四医院病理科)
刘运江(河北医科大学第四医院乳腺外科)
刘真真(河南省肿瘤医院乳腺外科)
路平(新乡医学院第一附属医院内科)
吕铮(吉林大学第一医院肿瘤内科)
马斌林(新疆医科大学附属肿瘤医院外科)
孟优(苏州市立医院乳腺外科)
莫钦国(广西医科大学附属肿瘤医院乳腺外科)
倪青(贵州省人民医院外科)
欧阳取长(湖南省肿瘤医院肿瘤内科)
潘跃银(安徽省肿瘤医院肿瘤内科)
任伟丽(绍兴市上虞人民医院外科)
石晶(中国医科大学附属第一医院肿瘤内科)
史业辉(天津医科大学肿瘤医院肿瘤内科)
宋传贵(福建省肿瘤医院乳腺外科)
宋张骏(陕西省人民医院乳腺外科)
孙蓓(天津医科大学第二医院日间)
孙正魁(江西省肿瘤医院乳腺外科)
佟仲生(天津医科大学肿瘤医院肿瘤内科)
王海波(青岛大学附属医院乳腺中心)
王浩(四川省肿瘤医院乳腺外科)
王洪江(大连医科大学附属第一医院乳腺外科)
王靖(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院乳腺外科)
王瓯晨(温州医科大学附属第一医院外科)
王淑莲(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院放疗科)
王树森(中山大学肿瘤防治中心肿瘤内科)
王欣(天津医科大学肿瘤医院乳腺外科)
王晓稼(浙江省肿瘤医院肿瘤内科)
王永胜(山东省肿瘤医院乳腺外科)
王勇(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院超声科)
王玉(山西省肿瘤医院放疗科)
吴斌(西南医科大学附属医院外科)
吴炅(复旦大学肿瘤医院乳腺外科)
吴新红(湖北省肿瘤医院乳腺外科)
应建明(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院病理科)
徐贵颖(吉林省肿瘤医院乳腺外科)
徐莹莹(中国医科大学附属第一医院乳腺外科)
於海军(武汉大学中南医院肿瘤内科)
于晓红(江油市九零三医院外科)
杨谨(西安交通大学附属第一医院肿瘤内科)
杨华伟(广西医科大学肿瘤医院乳腺外科)
杨碎胜(甘肃省肿瘤医院乳腺外科)
翟振华(锦州医科大学附属第一医院肿瘤内科)
曾晓华(重庆市肿瘤医院乳腺外科)
张殿龙(大连大学附属中山医院乳腺外科)
张钢龄(包头市肿瘤医院乳腺外科)
张莉莉(江苏省肿瘤医院乳腺内科)
张钧(河北医科大学第四医院放疗科)
张瑞(内蒙古医科大学附属医院甲乳外科)
张义侠(中国医科大学附属第一医院超声科)
赵兵(新疆医科大学附属肿瘤医院肿瘤内科)
赵久达(青海大学附属医院乳腺内科)
赵卫红(解放军总医院肿瘤内科)
赵玉兰(西藏自治区人民医院肿瘤科)
朱庆莉(北京协和医院超声科)
卓睿(桂林市中医医院中医外科)
来源:中华肿瘤杂志