2025年10月8日,复旦大学附属肿瘤医院叶定伟教授团队在Journal of Clinical Oncology(IF=41.9)上发表了题为“Efficacy and Safety of BL-B01D1 in Patients With Locally Advanced or Metastatic Urothelial Carcinoma: A Phase II Clinical Trial”的研究论文。该研究首次评估了BL-B01D1(靶向EGFR/HER3的双特异性抗体偶联药物)在经治局部晚期或转移性尿路上皮癌患者中的疗效与安全性。结果显示,在2.2 mg/kg剂量下,BL-B01D1显示出良好的初步疗效(确认的客观缓解率达44.1%,尤其既往仅1线化疗患者客观缓解率达80%),且安全性可控,提示其有望成为该类患者的新治疗选择。

研究背景
局部晚期/转移性尿路上皮癌(la/mUC)的标准疗法是铂类化疗,但其中位总生存期(OS)仅13.1-18.9个月;即便在维持治疗中加入免疫检查点抑制剂,也仅能延长2.7-7.1个月生存时间,患者预后仍差。近年来,抗体偶联药物(ADC)如enfortumab vedotin(EV)、disitamab vedotin(DV)和sacituzumab govitecan(SG)等逐渐成为后线治疗的重要选择,但其疗效在不同人群中存在差异,且耐药机制复杂。EGFR和HER3作为EGFR家族中在尿路上皮癌中高表达的成员,与不良预后相关,成为潜在的治疗靶点。BL-B01D1作为首个靶向EGFR/HER3的双特异性ADC,其I期研究已显示其在实体瘤中的抗肿瘤活性,本研究旨在进一步评估其在la/mUC患者中的疗效与安全性。
研究设计
BL-B01D1–201是一项在中国开展的多中心、单臂、II期临床试验,共纳入41例既往接受过至少一线系统治疗的la/mUC患者。患者分别接受2.2 mg/kg(n=34)、2.5 mg/kg(n=4)和2.75 mg/kg(n=3)的BL-B01D1静脉输注,每3周为一周期(第1、8天给药)。研究主要终点为客观缓解率(ORR),次要终点包括无进展生存期(PFS)、疾病控制率(DCR)、缓解持续时间(DOR)及安全性。
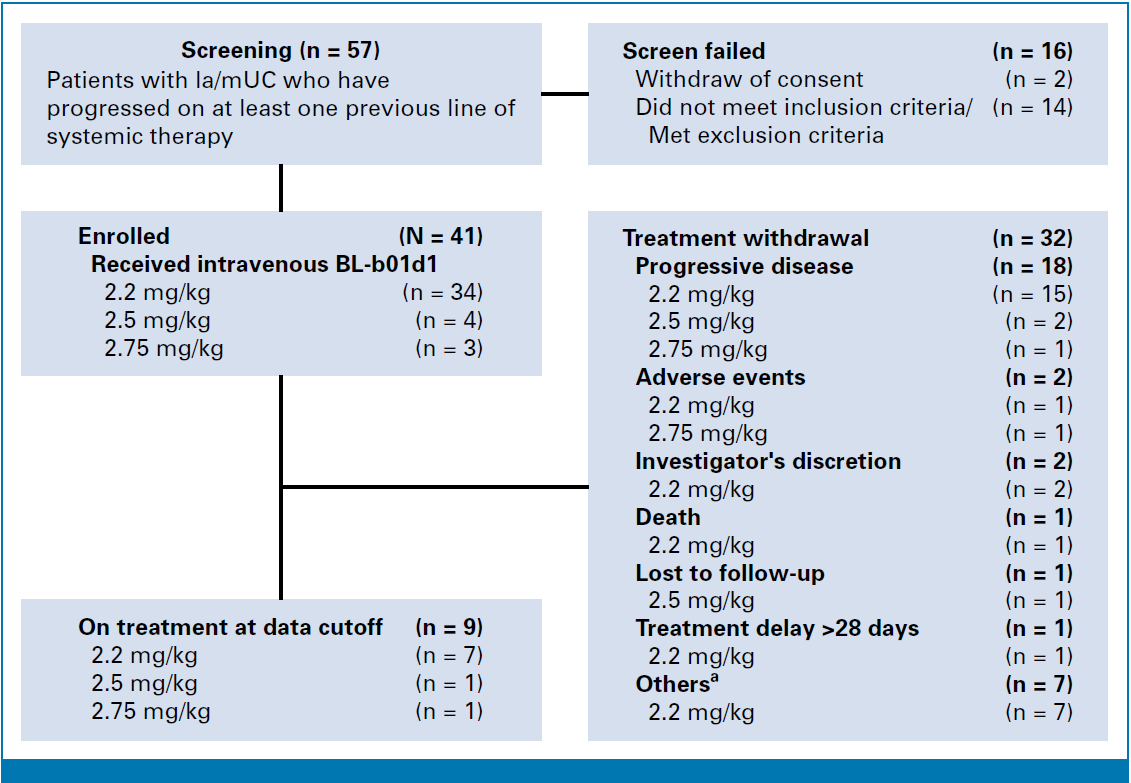
研究流程图
研究结果
1 疗效结果
在2.2 mg/kg剂量组中:
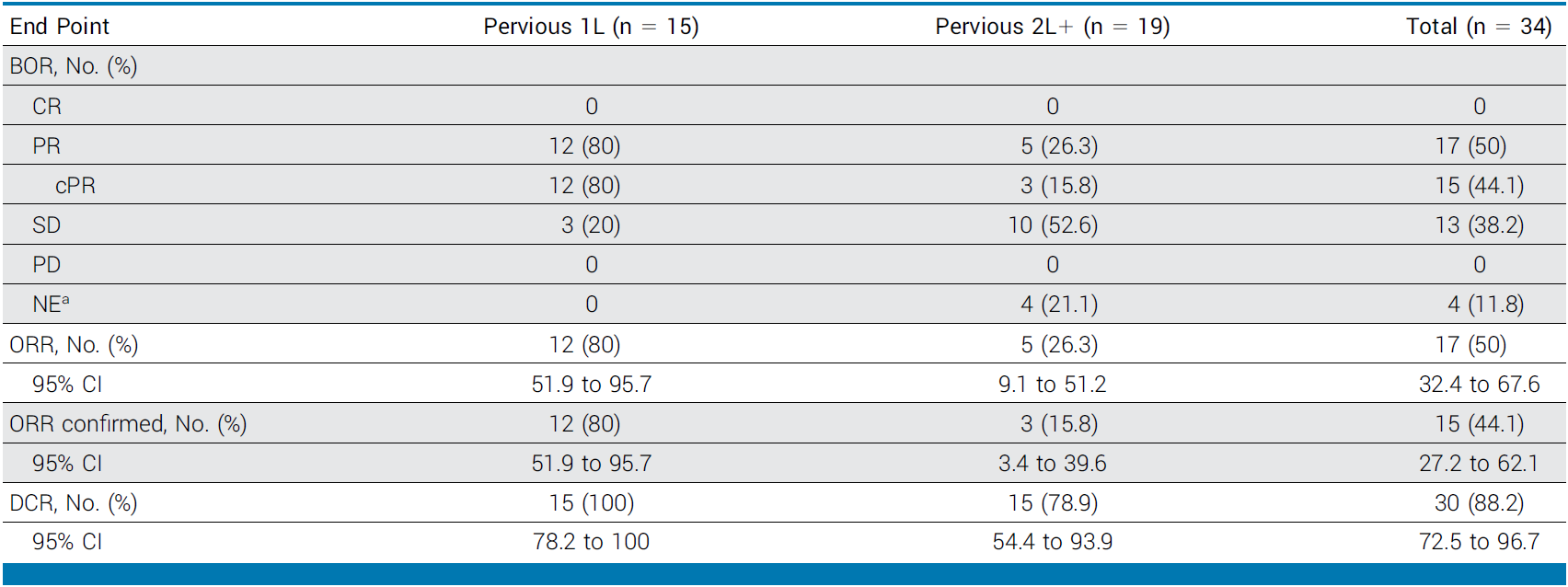
确认ORR:44.1%(95%CI 27.2-62.1),34例患者中15例达到确认PR(cPR);
DCR:88.2%(95%CI 72.5-96.7),仅4例未达到疾病控制(含3例未完成评估、1例未达SD最小间隔);
中位PFS(中位随访10.2个月):7.3个月(95%CI 5.5-9.8),6个月PFS率66.4%(95%CI 46.4-80.4);
中位DOR:11.3个月(95%CI 4.3-未达到[NR]),6个月DOR率69.8%(95%CI 31.8-89.4);
探索性OS:中位OS 12.3个月(95%CI 8.5-NR)。
值得注意的是,在15例仅接受过一线化疗的亚组中,ORR高达80%(95%CI 51.9–95.7),中位PFS未达到,6个月PFS率为100%,提示更早使用BL-B01D1可能带来更大获益。
此外,泳道图与瀑布图显示,多数患者靶病灶持续缩小,且缓解持续时间较长。在15例达cPR的患者中,13例截至数据截止时仍存活,6例仍在继续治疗。
表:2.2 mg/kg剂量组疗效数据
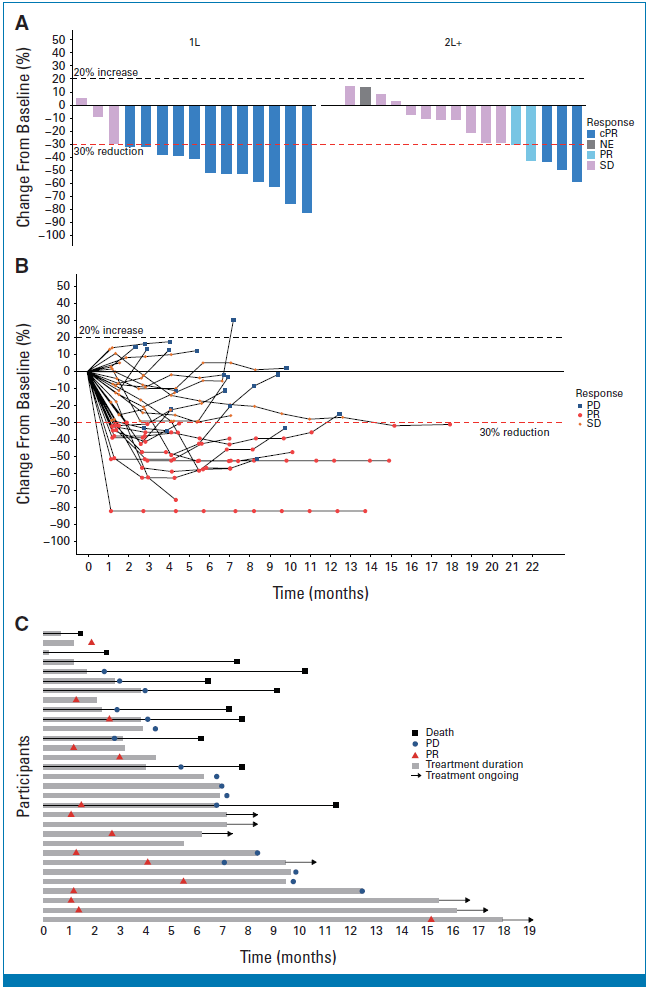
2.2 mg/kg剂量组抗肿瘤活性(A:病灶直径较基线变化;B:随时间推移病灶体积较基线变化;C:疗效变化)
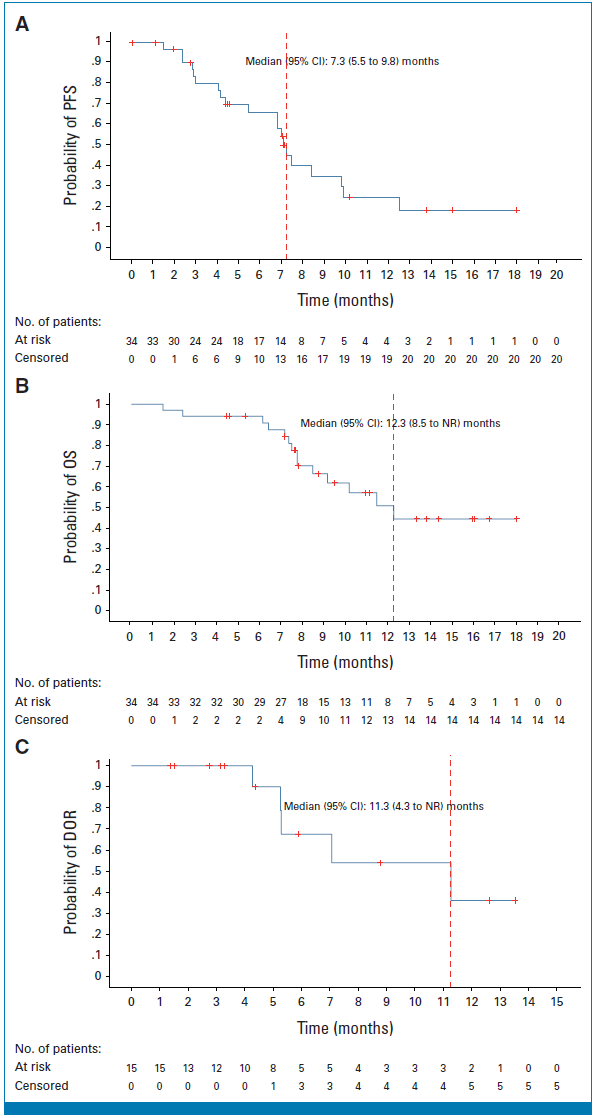
Kaplan-Meier图(A:PFS;B:OS;C:DOR)
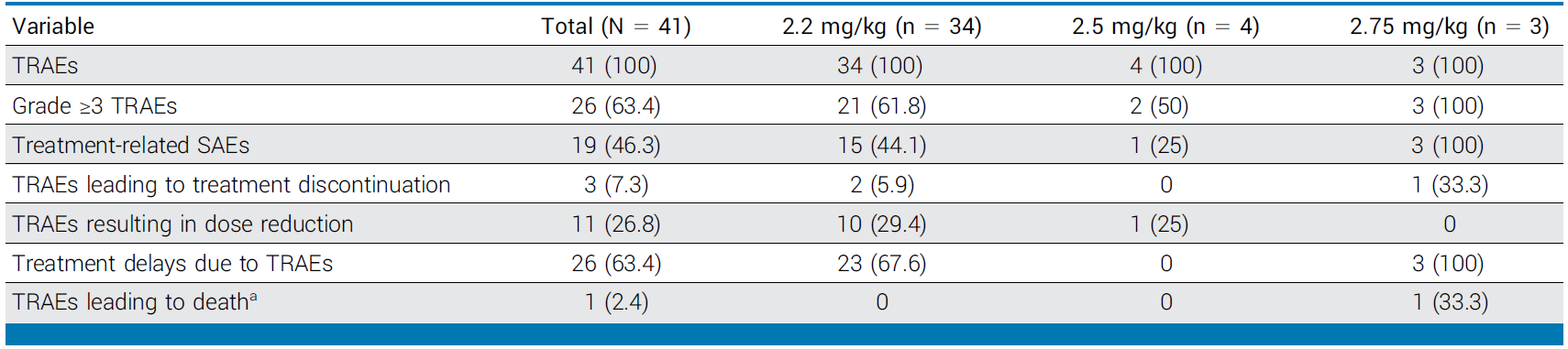
2 安全性分析
(1)2.2mg/kg组
所有患者均报告了至少一项治疗相关不良事件(TRAE)。最常见的TRAE为血液学毒性,包括贫血(88.2%)、白细胞减少(76.5%)、中性粒细胞减少(64.7%)和血小板减少(64.7%)。胃肠道事件如食欲下降(52.9%)和恶心(52.9%)也较常见,但多数为1-2级。
≥3级TRAE发生率为61.8%,治疗相关严重不良事件(SAEs)发生率为44.1%。两例患者因TRAE终止治疗,10例患者需减量。值得注意的是,未观察到间质性肺病、眼部毒性或周围神经病变等ADC相关特殊毒性。
(2)2.5mg/kg组
100%出现TRAEs,50%为≥3 级,无停药或死亡病例。
(3)2.75mg/kg组
3例患者均在第1周期出现≥3 级TRAEs,1例因中性粒细胞减少合并感染及COVID-19死亡(距末次给药>28天,非直接治疗相关)。
表:不良事件
3 生物标志物探索
对2.2mg/kg组11例患者的肿瘤样本进行IHC检测,结果显示:所有样本EGFR表达为2+/3+,HER3表达为0至3+;虽在不同EGFR/HER3表达水平患者中均观察到临床活性,但因样本量小,未发现二者表达水平与抗肿瘤疗效的明确关联。
研究结论
BL-B01D1在经治la/mUC中表现出良好的疗效与可控的安全性,尤其在一线化疗后患者中疗效显著。该药物有望成为该类患者的新治疗选择,其进一步验证性III期研究(NCT06857775)已启动,值得期待。
来源:肿瘤界