2025年9月23日,复旦大学附属肿瘤医院邵志敏/江一舟教授团队在Cell Metabolism上发表了题为“HEBP2-governed glutamine competition between tumor and macrophages dictates immunotherapy efficacy in triple-negative breast cancer”的研究论文。该研究揭示三阴性乳腺癌中HEBP2高表达肿瘤细胞通过激活GSTP1过度消耗谷氨酰胺,诱发抗肿瘤的CCL3+巨噬细胞铁死亡,从而削弱免疫疗效。研究提出靶向GSTP1可增强PD-1抑制剂疗效,为基于单细胞代谢图谱的精准免疫治疗提供了新范式。

研究背景
三阴性乳腺癌(TNBC)是指雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER-2)表达均为阴性的一类乳腺癌,约占所有乳腺癌的15%,具有复发率高、死亡率高的特点。近年来,免疫检查点阻断(ICB)治疗(如抗 PD-1/PD-L1)为TNBC带来新希望,但仅少数患者能从单药或联合化疗中长期获益,因此,亟待开发更有效的联合治疗策略,以扩大三阴性乳腺癌患者群体中对免疫疗法产生有效应答的比例。
已知肿瘤微环境(TME)中肿瘤细胞与免疫细胞之间的代谢相互作用是影响免疫治疗应答的关键因素:肿瘤细胞常通过竞争营养物质(如蛋氨酸、谷氨酰胺)抑制免疫细胞功能,且代谢产物(如乳酸)可诱导免疫抑制。然而,由于肿瘤细胞与微环境免疫细胞代谢过程的重叠性与代谢物作用的多样性,传统代谢药物治疗窗口有限且可能引发显著毒性。为克服这一挑战,深入解析TNBC中复杂的代谢交互作用及其分子机制至关重要。
本研究旨在通过高分辨率单细胞技术与空间多组学技术,揭示TNBC中关键的免疫代谢调控轴,并为联合治疗策略提供理论依据。
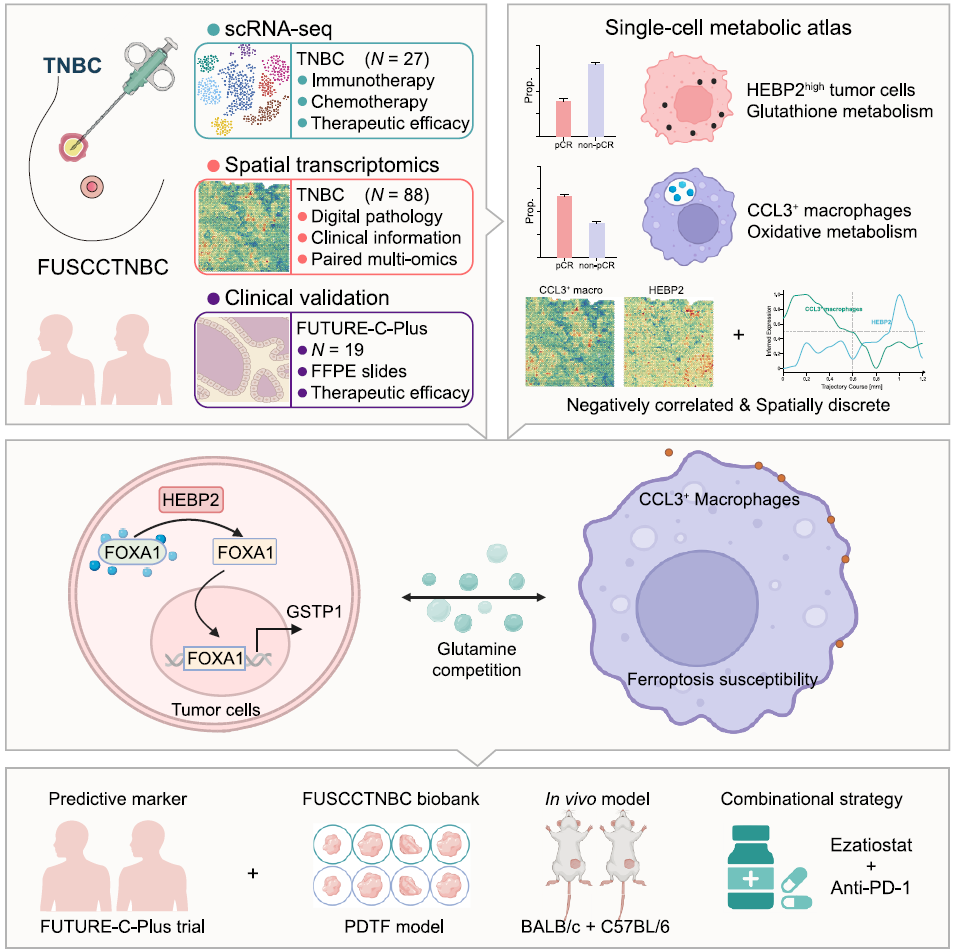
研究设计
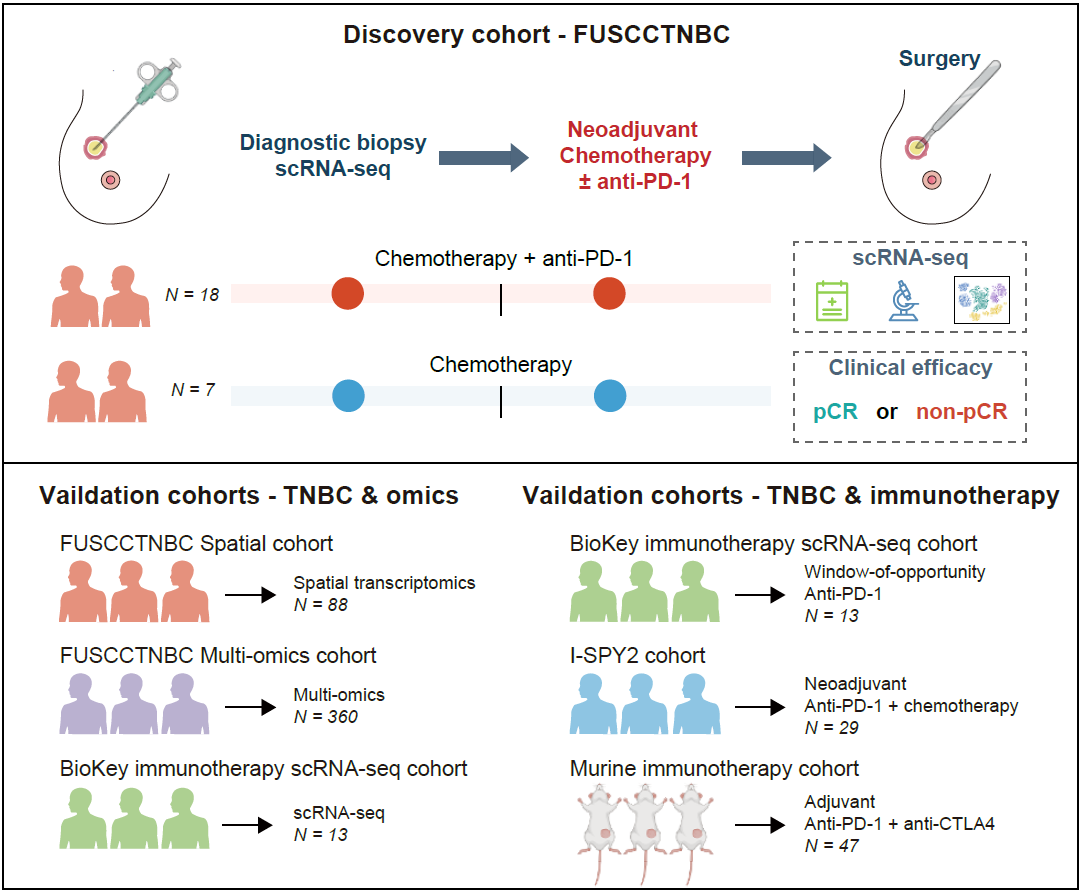
研究团队构建了多个TNBC患者队列,包括:
scRNA-seq发现队列:纳入27例早期TNBC患者,其中18例接受新辅助化疗联合抗PD-1治疗,7例仅接受化疗,2例因治疗中断缺乏疗效数据;治疗前采集肿瘤活检样本进行scRNA-seq,用于鉴定疗效相关细胞亚群。
空间队列:纳入88例TNBC患者,通过高分辨率空间分子成像(SMI)技术进行转录组测序,验证肿瘤-免疫细胞的空间分布关系。
验证队列:包括外部scRNA-seq数据集(如BioKey、TCGA)、小鼠模型及临床免疫治疗队列(如I-SPY2、FUTURE-C-Plus)。
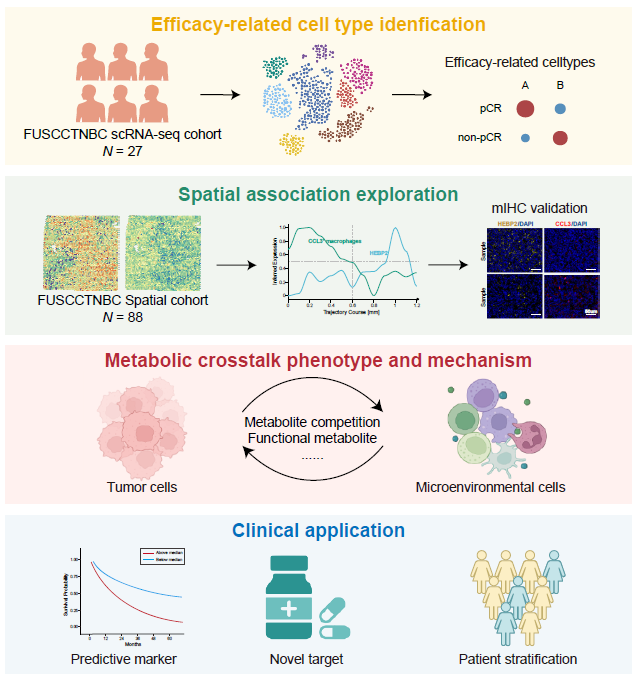
研究结果
鉴定TNBC免疫治疗疗效相关的核心细胞亚群
研究首先通过cNMF分析scRNA-seq数据,在肿瘤细胞中识别出6个核心代谢编程(P1-P6),其中P1与免疫治疗疗效最差显著相关,且富集于“谷胱甘肽代谢”通路。P1的特征基因中,HEBP2表达最高,且特异性富集于肿瘤细胞中。另一方面,研究发现CCL3+巨噬细胞(占髓系细胞的 12.9%)与免疫治疗疗效、“免疫热”TME正相关。
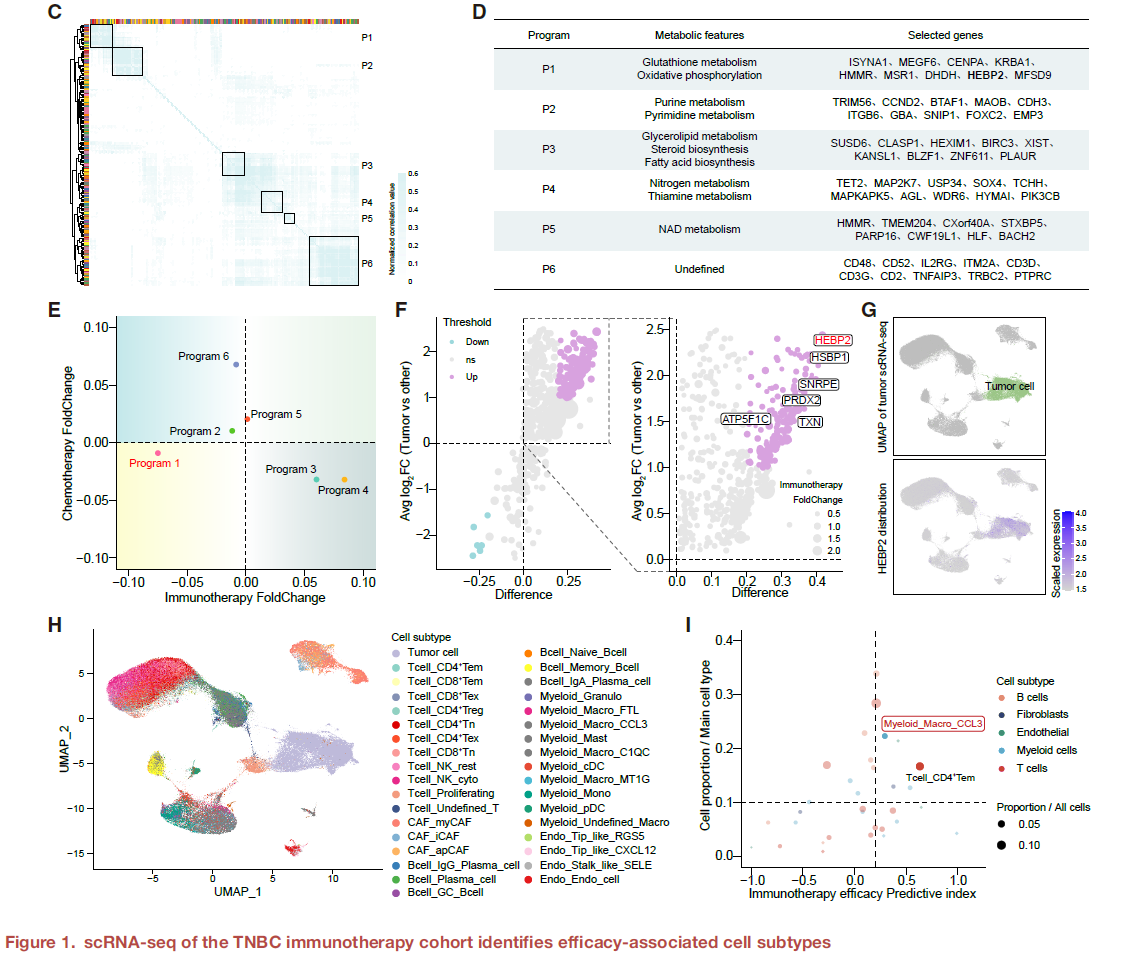
HEBP2high肿瘤细胞与CCL3+巨噬细胞的代谢特征:谷氨酰胺代谢为核心关联点
为探索两者的代谢交互潜力,研究分别解析其分子与代谢特征,功能实验表明:
HEBP2high肿瘤细胞具有活跃的谷胱甘肽代谢和谷氨酰胺消耗能力;
CCL3+巨噬细胞具有促炎表型、高氧化代谢活性,并对谷氨酰胺饥饿敏感,提示其依赖谷氨酰胺维持抗氧化能力以抵抗铁死亡。
上述结果提示,HEBP2high肿瘤细胞与CCL3+巨噬细胞可能通过谷氨酰胺竞争发生代谢交互。
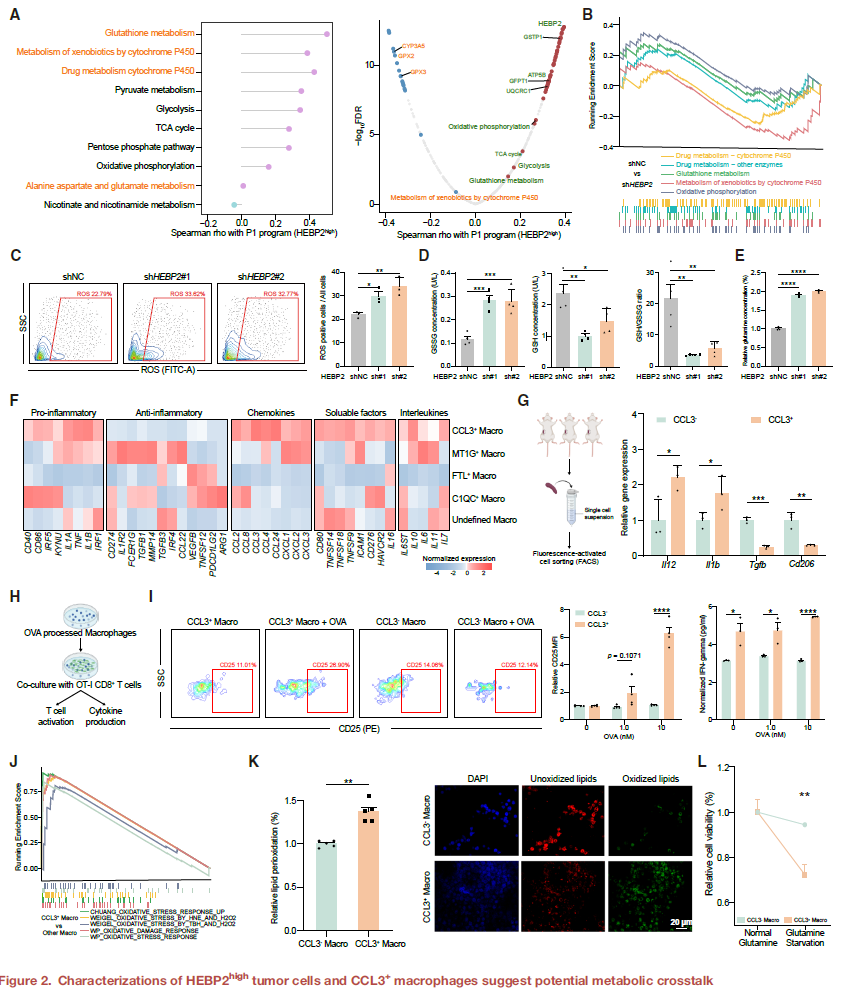
HEBP2high肿瘤细胞与CCL3+巨噬细胞在“数量-空间”双重负相关
在scRNA-seq和空间转录组数据中,HEBP2表达与CCL3+巨噬细胞丰度呈显著负相关。空间分析进一步显示,HEBP2high肿瘤细胞与CCL3+巨噬细胞在组织空间中互斥,而HEBP2low区域则与CCL3+巨噬细胞共定位。这种空间分布模式在人类和小鼠模型中均得到验证。
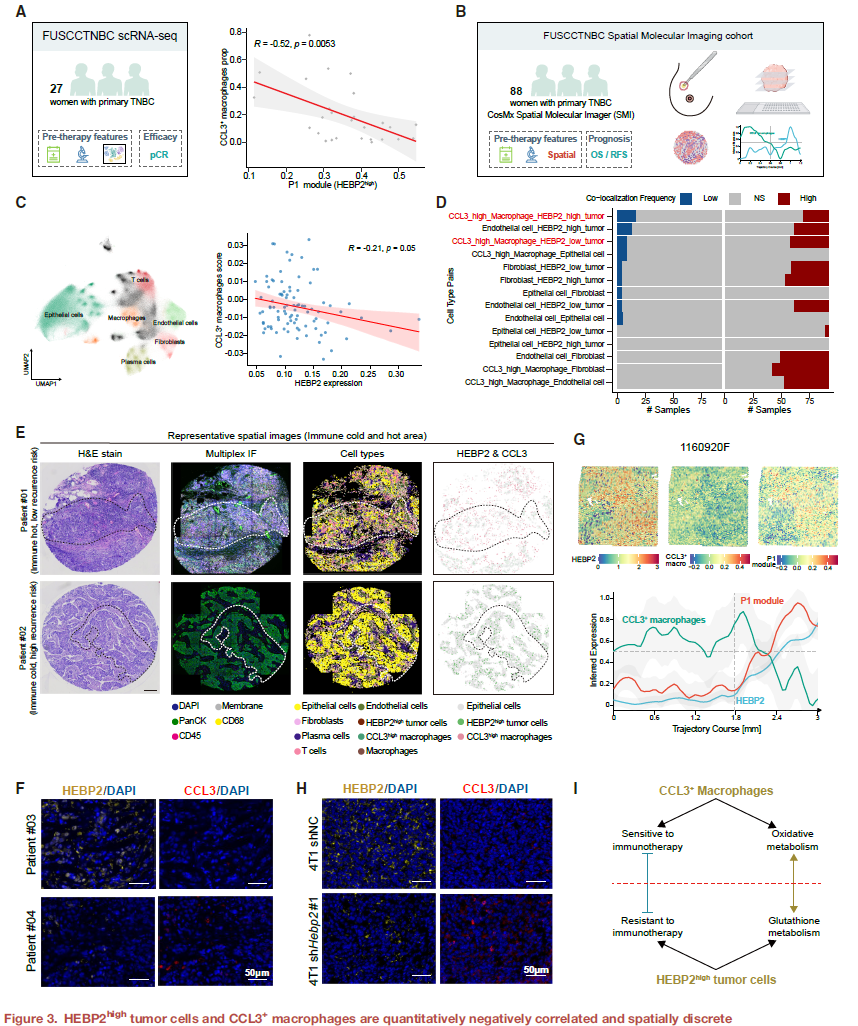
HEBP2通过GSTP1促进谷氨酰胺竞争诱导CCL3+巨噬细胞铁死亡
鉴于观察到HEBP2high肿瘤细胞与CCL3+巨噬细胞在数量上和空间上均呈负相关,研究探索了肿瘤细胞中HEBP2的表达是否能在体内抑制CCL3+巨噬细胞的浸润。数据表明,在TNBC肿瘤中抑制HEBP2能显著提升CCL3+巨噬细胞的浸润,并引发肿瘤微环境向炎症表型转变。
进一步的体外共培养实验证实,谷氨酰胺介导了HEBP2high肿瘤细胞与CCL3+巨噬细胞之间的代谢交互。肿瘤细胞中的HEBP2显著诱导了CCL3+巨噬细胞的死亡,而外源性谷氨酰胺补充可逆转该效应。深入研究死亡机制发现,HEBP2通过竞争性消耗谷氨酰胺来促进CCL3+巨噬细胞发生铁死亡,这一效应同样可通过补充谷氨酰胺逆转,这一发现凸显了HEBP2在TNBC肿瘤细胞中的代谢调控作用。
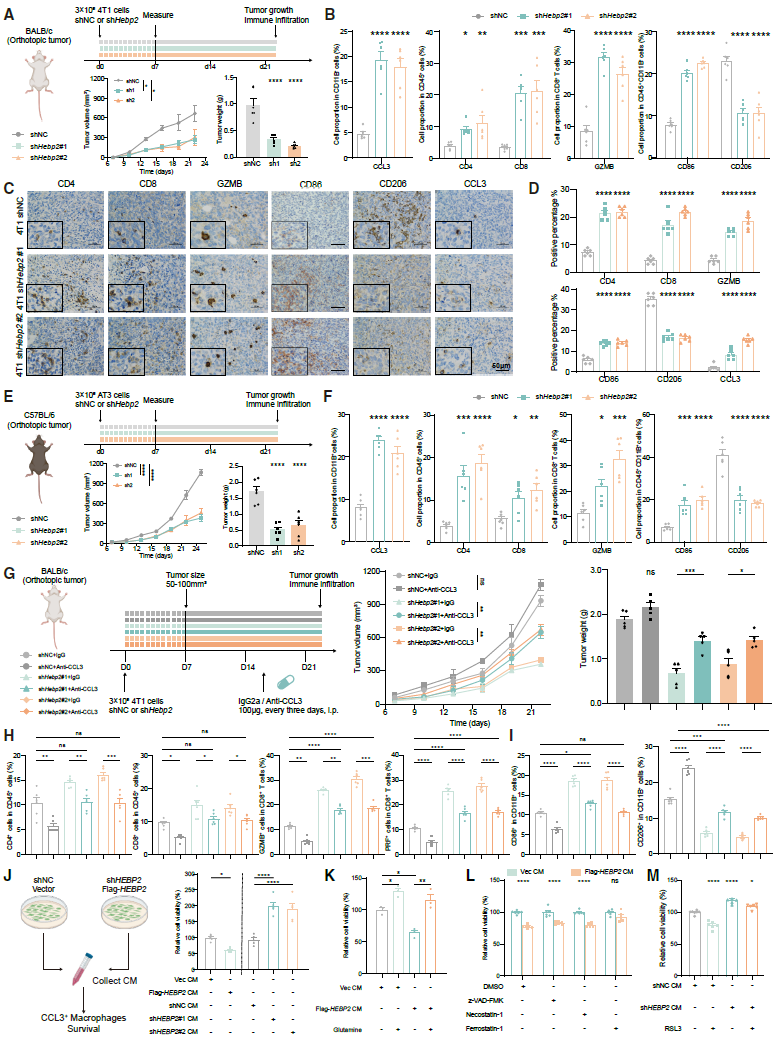

为了进一步研究其详细机制,研究探索了HEBP2的下游分子。结果,谷胱甘肽S-转移酶P1(GSTP1),一种利用还原型谷胱甘肽进行解毒和抗氧化保护的酶,被筛选为HEBP2的潜在下游靶点。分析表明GSTP1可以介导肿瘤细胞对谷氨酰胺的过度消耗。在HEBP2过表达的细胞中敲低GSTP1,可以挽救HEBP2对谷氨酰胺代谢的影响,并保护CCL3+巨噬细胞免受铁死亡,揭示了HEBP2-GSTP1轴可作为一个潜在的治疗靶点。
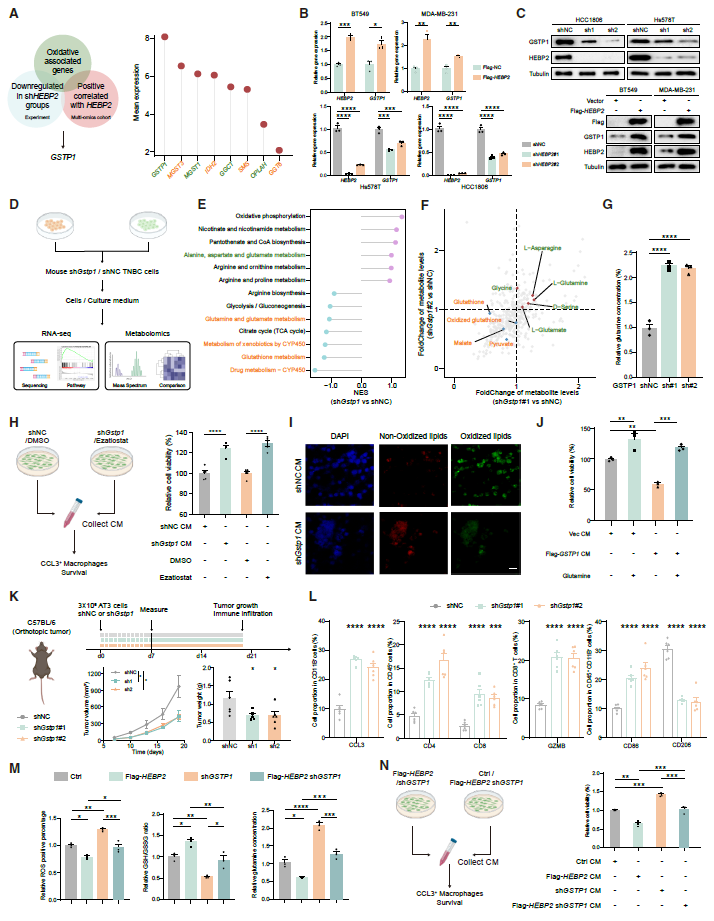

HEBP2很可能在转录水平影响GSTP1的表达。然而,作为一个胞质蛋白,HEBP2调节GSTP1 mRNA表达的具体机制仍不清楚。通过筛选GSTP1的潜在转录因子和HEBP2的相互作用蛋白,研究确定了经典转录因子FOXA1可能是HEBP2和GSTP1之间的中介分子。进一步发现HEBP2可直接结合FOXA1,抑制其在胞质中的相分离,促进其核转位,并调节GSTP1的转录。
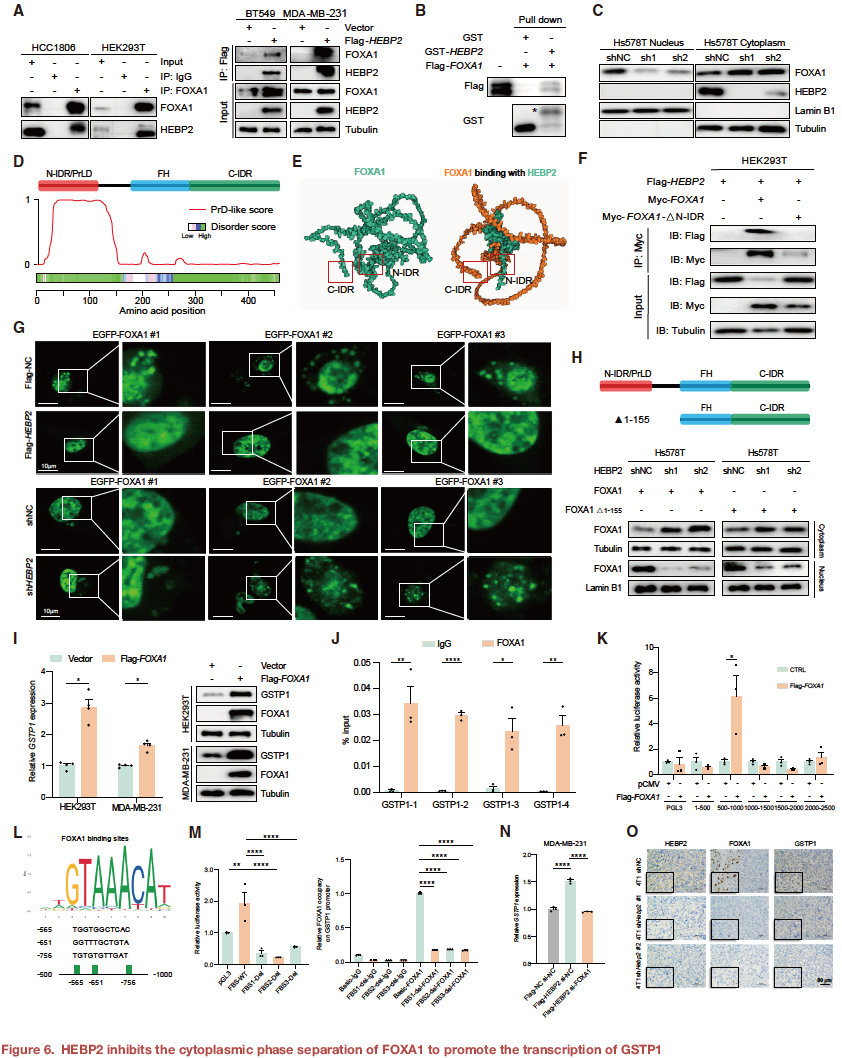
以上发现共同揭示了HEBP2抑制FOXA1胞质相分离促其核转位,上调GSTP1增强肿瘤谷氨酰胺消耗,致CCL3+巨噬细胞铁死亡。
靶向GSTP1增强免疫治疗疗效
基于上述机制,研究探索GSTP1抑制剂(ezatiostat)联合抗PD-1的治疗潜力,通过体内小鼠协同模型、体外患者来源肿瘤片段(PDTF)模型以及多个临床免疫治疗队列验证其有效性:
在4T1小鼠模型中,GSTP1敲除或使用其抑制剂ezatiostat联合抗PD-1治疗,较单一疗法更显著抑制肿瘤生长。联合治疗还提高了CD4+细胞、CD8+细胞、PRF+CD8+T细胞、GZMB+CD8+T细胞及CD86+细胞的比例,同时降低了CD206+细胞的比例。
在患者来源肿瘤片段(PDTF)模型中,联合治疗较基线增强了T细胞活化标志物(CD69、OX40和CD25)和细胞因子(IFN-γ、TNF-α)的表达。
临床队列验证:
I-SPY2 队列(29例接受新辅助免疫治疗的早期TNBC):达到病理完全缓解(pCR)的患者,基线HEBP2、GSTP1表达较低,CCL3表达较高。
FUTURE-C-Plus 队列(19例接受免疫治疗的转移性TNBC):CCL3高表达、HEBP2/GSTP1低表达提示客观缓解率(ORR)更高。
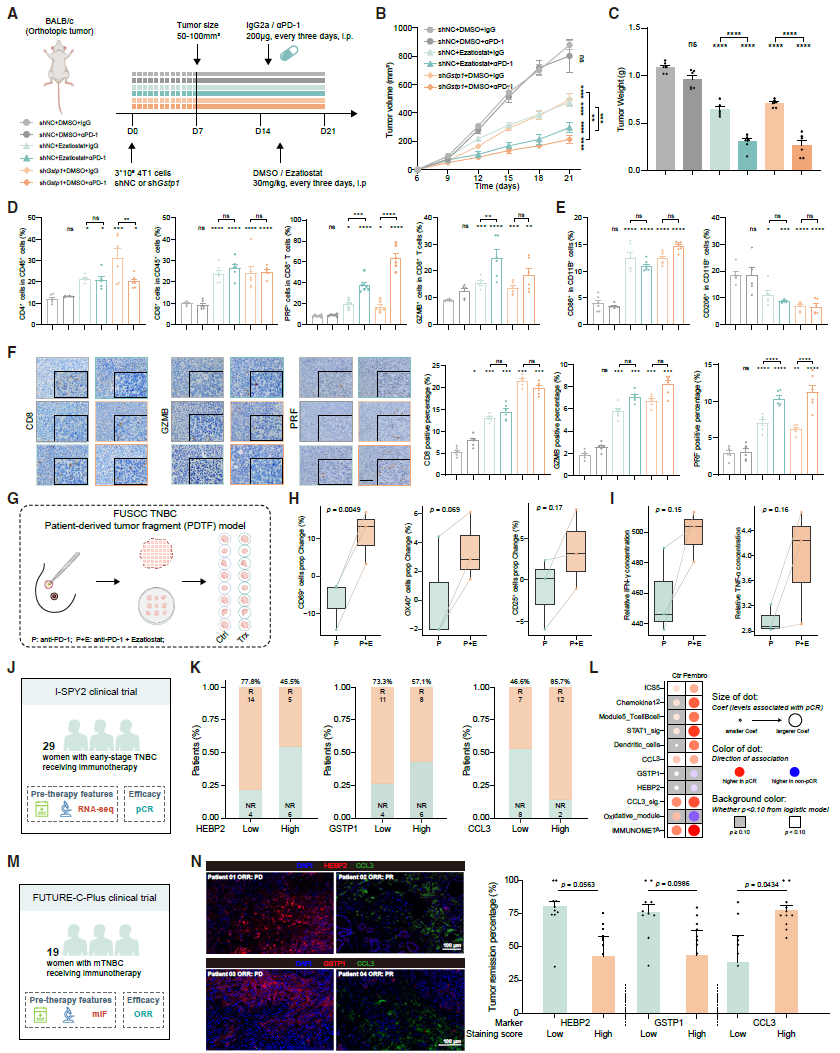

总之,研究通过scRNA-seq识别出一种肿瘤特异性代谢靶点GSTP1,并证实GSTP1抑制剂联合ICB是治疗TNBC患者的优化治疗策略,该方案既能最大化治疗效果,又能最小化不良反应。此外,研究确立了HEBP2、GSTP1和CCL3的表达水平可作为预测免疫治疗反应的可靠指标。
研究结论
该研究首次阐明HEBP2-FOXA1-GSTP1轴通过谷氨酰胺竞争调控TNBC免疫治疗疗效的机制,不仅为理解TME代谢相互作用提供新视角,更推动 GSTP1抑制剂从“代谢靶向”向“免疫增敏”的临床转化,为TNBC患者的精准免疫治疗奠定基础。
来源:肿瘤界