2025年8月18日,复旦大学附属肿瘤医院邵志敏教授、江一舟教授、金希教授团队在Cancer Research发表题为“Subtyping-Directed Precision Treatment Refines Traditional One-Size-Fits-All Therapy for HR+/HER2- Breast Cancer”的研究论文。团队通过整合 “基础研究(bench,多组学测序及功能性药物反应检测)”与“临床研究(bedside,多中心真实世界队列及临床试验队列)”数据,建立了HR+/HER2-乳腺癌的“复旦四分型”,并针对性提出精准治疗策略,验证了其在真实世界队列及临床试验中的优越性,为打破传统“一刀切”内分泌治疗局限提供了新范式。

研究背景
激素受体阳性、人表皮生长因子受体2阴性(HR+/HER2-)乳腺癌占所有乳腺癌的70%,是目前最常见的亚型。传统上,该类患者普遍接受内分泌治疗,即“一刀切”(one-size-fits-all)策略。尽管该策略在一定程度上降低了复发和死亡风险,但由于肿瘤异质性的存在,患者对治疗的反应差异显著,部分患者会出现原发性或继发性耐药。近年来,针对特定基因组变异(如PIK3CA突变、BRCA1/2突变)的靶向治疗和CDK4/6抑制剂的应用,虽然丰富了治疗选择,但仍只能惠及部分患者。因此,亟需一种更系统、更全面的分子分型体系,以实现真正意义上的精准治疗。
在该团队前期的研究中(DOI:10.1038/s41588-023-01507-7),通过对早期队列进行多组学分析,揭示了HR+/HER2-乳腺癌的分子异质性,将该疾病划分为四种不同的亚型:经典腔面型(SNF1)、免疫调节型(SNF2)、增殖型(SNF3)和RTK驱动型(SNF4)。这些发现为HR+/HER2-乳腺癌的分类和个体化治疗奠定了基础。
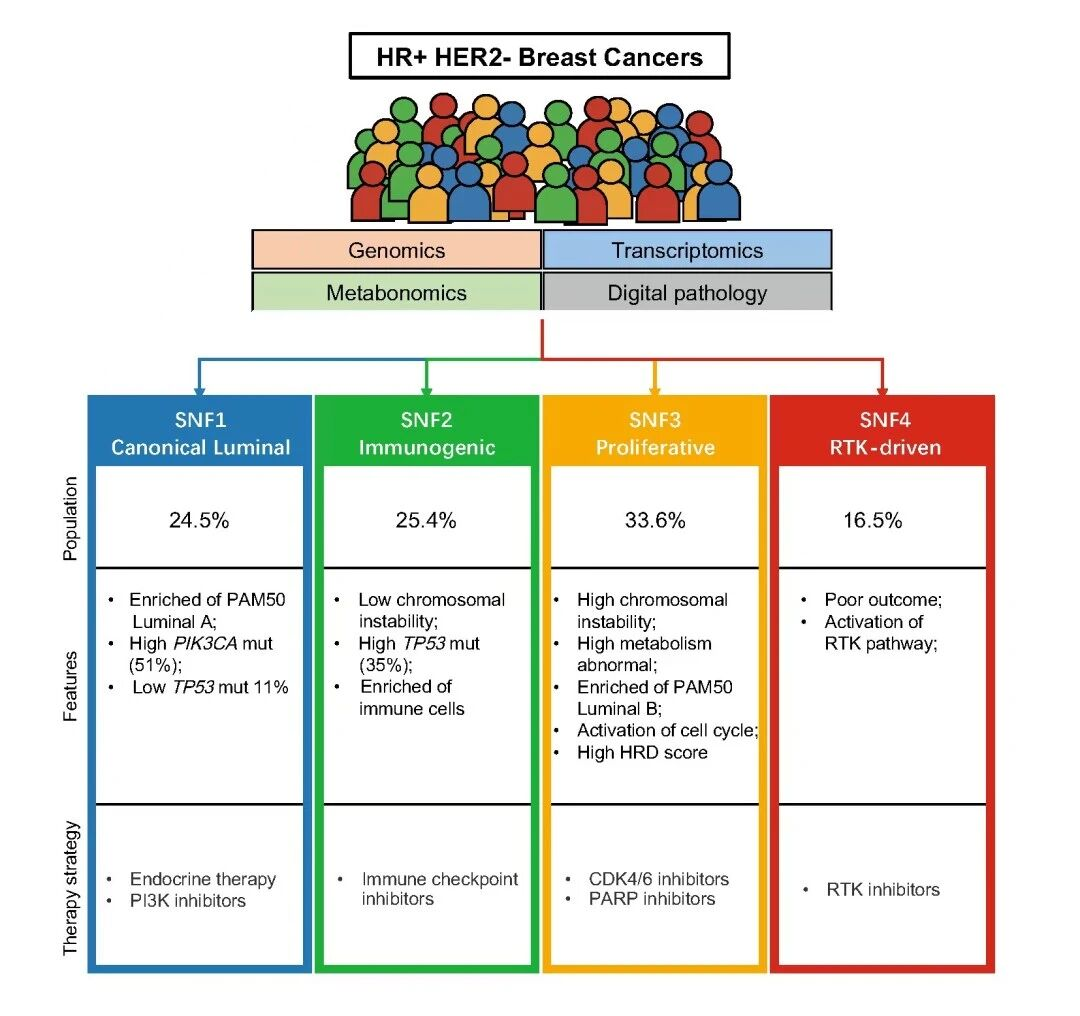
然而,SNF分型系统在早期和晚期患者中的有效性仍需进一步研究。本研究旨在扩展先前的工作,探索不同亚型的临床价值,并检验哪些患者会对何种治疗产生反应及其原因。
研究设计
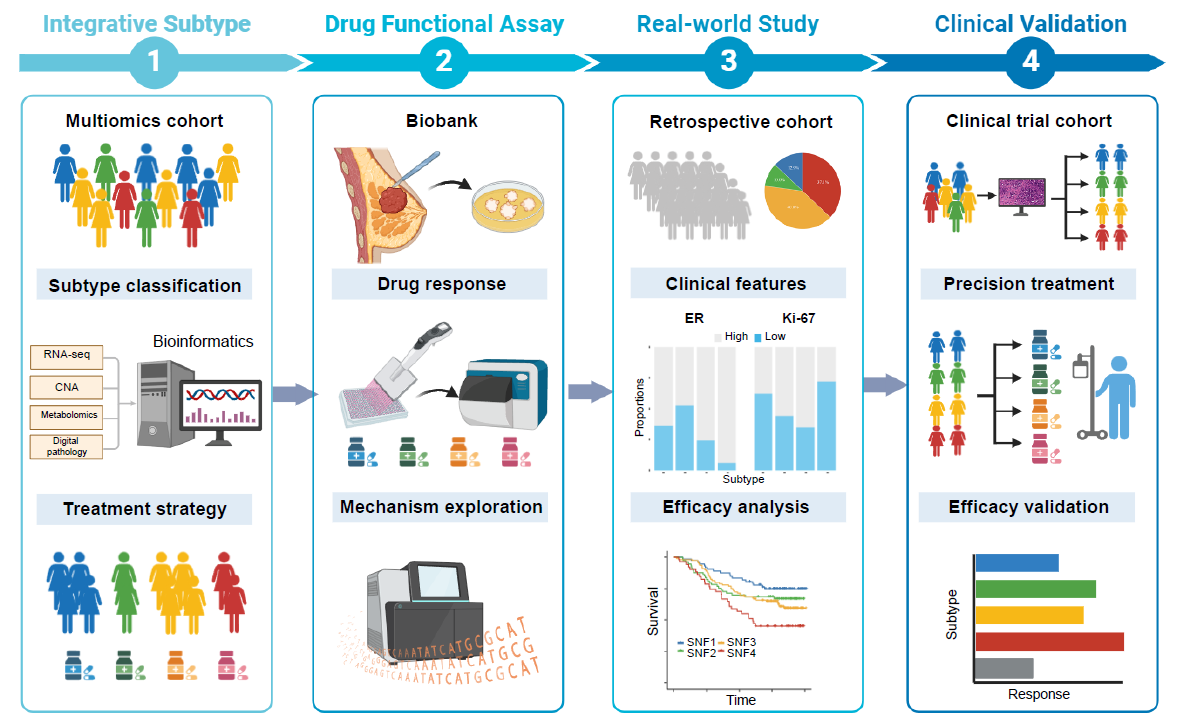
研究通过整合多组学数据、功能性药物检测、多中心真实世界队列和临床试验数据,构建并验证了一套基于分子分型的精准治疗策略。主要包括以下四个部分:
多组学队列分析:对351例HR+/HER2-早期乳腺癌患者进行全外显子测序(WES)、拷贝数变异(CNA)和转录组测序(RNA-seq),将其分为四个分子亚型(SNF subtypes)。
药物反应检测:建立患者来源类器官(PDO)和患者来源肿瘤片段(PDTFs)模型,测试不同亚型对多种药物的敏感性。
真实世界队列分析:收集来自4家医疗中心的643例HR+/HER2-乳腺癌患者的临床和数字病理数据(其中早期乳腺癌[n=216]、晚期乳腺癌[n=427]),验证亚型与临床特征、治疗反应的相关性。
临床试验验证:利用I-SPY2试验数据和真实世界难治性患者队列(n=134),验证分型指导的治疗策略的有效性。
研究结果
团队最终提出针对四亚型的精准治疗方案:
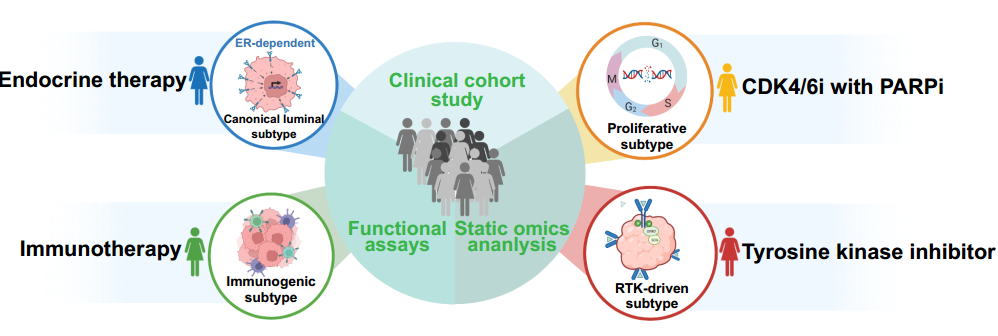
分型导向精准治疗策略
经典腔面型(Canonical Luminal Subtype,SNF1):内分泌单药治疗(无需联合其他靶向药物,避免过度治疗)
分子基础:雌激素受体(ER)信号通路高度活跃,SET指数(内分泌治疗敏感性指数)最高;多种内分泌治疗耐药通路(如细胞周期、RTK、PI3K、WNT、EMT通路)的表达水平最低。
实验验证:PDO模型显示,SNF1亚型类器官对三种内分泌治疗(雌激素剥夺、4-羟基他莫昔芬、氟维司群)最敏感,肿瘤细胞活力(cell viability)最差。
临床验证:临床预后分析显示,SNF1亚型患者对单纯内分泌治疗反应良好,其复发和转移风险较低,因此无需盲目强化治疗。
免疫调节型(Immunogenic Subtype,SNF2):免疫检查点抑制剂(抗PD-1/PD-L1)
分子基础:肿瘤微环境(TME)中富集激活的树突状细胞、浆细胞、CD8+T细胞、活化的自然杀伤细胞和M1巨噬细胞,是典型的“免疫热肿瘤”;PD-L1表达水平最高。
实验验证:
PDTF模型验证:SNF2亚型肿瘤片段经PD-1抑制剂处理后,T细胞活化标志物(ICOS、CD137、OX40、CD25)上升幅度高于其他亚型,细胞因子(IFN-γ,TNF-α)水平提升。
免疫共培养模型:SNF2亚型肿瘤细胞与自体T细胞共培养时,PD-1抑制剂使肿瘤细胞活力下降。
临床验证:I-SPY2试验显示:SNF2亚型患者接受PD-1抑制剂治疗的病理完全缓解率(pCR率)显著高于接受其他靶向治疗或化疗的对照组(P=0.013)。
增殖型(Proliferative Subtype,SNF3):CDK4/6抑制剂联合PARP抑制剂
分子机制:细胞周期相关信号通路高度活跃;染色体不稳定性(CIN)和同源重组缺陷(HRD)评分高(无论BRCA1/2是否突变)。
实验验证:PDO模型验证:SNF3类器官在长期低剂量内分泌药物诱导后,表现出对内分泌治疗的敏感性下降,模拟了临床的获得性耐药;SNF3亚型类器官对单药CDK4/6抑制剂和单药PARP抑制剂均表现出敏感性,两者联用显示出协同效应,抑制效果显著优于单药,且在诱导耐药后效果更佳。
临床验证:真实世界晚期队列分析发现,SNF3亚型患者在接受单纯内分泌治疗(氟维司群为基础)时,其无进展生存期(PFS)较短,提示易耐药。而接受CDK4/6抑制剂治疗后,该亚型患者达到部分缓解(PR)的比例更高。
RTK驱动型(RTK-Driven Subtype,SNF4):靶向PDGFR/VEGFR的酪氨酸激酶抑制剂(TKI)
分子机制:受体酪氨酸激酶(RTK)通路高度激活,尤其PDGFR、VEGFR家族表达显著升高。
实验验证:通过包含11种TKI的药物面板测试,发现SNF4 PDO对多种TKI敏感,尤其对索拉非尼和法米替尼的IC50值最低。经索拉非尼和法米替尼处理后,PDGF信号通路被特异性抑制,而VEGF信号通路变化不大,提示PDGFR通路是SNF4亚型的核心依赖性通路。SNF4 PDO对内分泌治疗的敏感性最低,表明其对雌激素依赖性信号通路的依赖性较低,但高度依赖于RTK通路。
临床验证:真实世界队列中,晚期患者中SNF4亚型的比例显著增加(P<0.01),表明其侵袭性强、更容易复发转移,预后较差。
研究结论
研究开发了可应用于临床的、基于深度学习的数字病理分型方法,结果显示:在真实世界队列及I-SPY2临床试验中,由“亚型导向精准治疗策略”指导的匹配治疗,疗效显著优于非匹配治疗方案。总体而言,本研究证实了亚型导向精准治疗策略在HR+/HER2-乳腺癌治疗中的优越性。该研究构建了一个从分子分型→功能性验证→临床回顾性及前瞻性验证的完整闭环,为HR+/HER2-乳腺癌的精准治疗提供了强有力的证据和支持。
来源:肿瘤界