2025年8月20日,北京大学生物医学前沿创新中心(BIOPIC)张泽民课题组在Springer Nature旗下免疫学期刊Cellular & Molecular Immunology发表题为“SARDH in the 1-C metabolism sculpts the T-cell fate and serves as a potential cancer therapeutic target”的研究论文。

基于T细胞的免疫疗法在癌症治疗领域展现出了巨大潜力。然而,肿瘤内部存在多种免疫抑制因素,致使T细胞呈现耗竭等失能状态,进而影响治疗效果。近年来,肿瘤内部特殊代谢环境,如缺氧、营养物质匮乏等因素对T细胞的抑制作用,受到了越来越多的关注。线粒体作为代谢的主要场所,其功能状态与T细胞耗竭等表型状态密切相关。本研究聚焦于肿瘤环境中T细胞的线粒体代谢重塑,致力于寻找影响T细胞功能命运的关键通路和基因。
研究从泛癌种T细胞的大规模单细胞转录组数据入手,通过分析肿瘤微环境对线粒体代谢通路和基因在转录水平的重塑,提出了一碳代谢(1-C)中的肌氨酸脱氢酶(sarcosine dehydrogenase, SARDH)可作为潜在的T细胞代谢检查点这一概念。研究发现,SARDH通过影响T细胞内肌氨酸-甘氨酸代谢稳态,进一步影响T细胞内部的甲基化表观遗传修饰状态,从而对T细胞信号通路活性及功能状态起到调节作用。干扰SARDH的表达能够优化TCR-T等细胞免疫治疗的效果。此外,研究发现SARDH在T细胞中的表达或许与肿瘤组织中的一碳代谢转录失调及肌氨酸积累现象有关,进一步阐明了代谢环境与T细胞功能命运之间的关联。
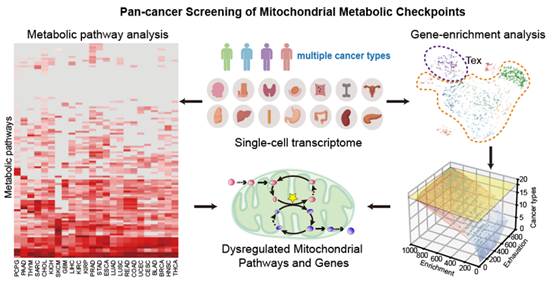
图 1 线粒体代谢相关候选基因筛选的计算分析流程示意图
为系统解析肿瘤浸润T细胞的代谢重编程机制,本研究构建了大规模泛癌种单细胞转录组分析框架(图 1)。通过分析十余种癌症类型的114条主要代谢通路,比较肿瘤内部和正常组织中T细胞转录水平的代谢差异。同时,综合18种癌症类型的215,444个T细胞的单细胞转录组数据,分析线粒体代谢基因的在T细胞亚类的表达情况,最终确定一碳代谢中的基因SARDH与T细胞失能高度相关。
SARDH在一碳代谢中催化肌氨酸脱氢生成甘氨酸的反应,是肌氨酸代谢的关键步骤。研究表明,SARDH在多个层面抑制T细胞功能。它抑制T细胞干性维持与免疫应答,限制T细胞的增殖、迁移与肿瘤浸润能力。基于肿瘤类器官和小鼠皮下荷瘤模型的研究显示,降低SARDH的表达可延缓肿瘤生长,增加T细胞浸润、增殖及细胞毒性。在靶向MART-1的TCR-T细胞中敲低SARDH的表达,能够增强其清除黑色素瘤(MART-1+ A375)的能力。
机制实验显示,SARDH通过调控其底物肌氨酸代谢来抑制T细胞功能。干扰SARDH表达会阻断肌氨酸向甘氨酸的转化,改变肌氨酸/甘氨酸相对浓度,并可能通过影响逆反应使反应相关代谢物SAM的相对水平升高。SAM作为重要的甲基化供体,影响多种表观遗传修饰,研究发现,敲低SARDH会增强组蛋白H3K79me2修饰水平,促进NF-κB信号激活等相关基因的表达,从而提升T细胞功能状态。进一步的实验表明,肌氨酸刺激可诱导T细胞中SARDH的表达,这一负反馈机制可能与维持细胞内肌氨酸等物质的稳态有关。患者样本分析显示,肿瘤组织肌氨酸水平显著高于正常组织,肿瘤浸润T细胞SARDH表达亦相对较高,提示肌氨酸驱动的SARDH上调是肿瘤抑制免疫的机制之一,与肿瘤微环境中的其他抑制性因素共同加剧T细胞功能障碍。
综上,本研究综合运用基于大规模泛癌种单细胞测序的T细胞代谢通路与基因表达分析方法、体内外功能实验以及机制研究手段,系统地刻画了T细胞线粒体代谢在肿瘤当中的重塑。在此基础上,成功鉴定出一碳代谢酶SARDH为T细胞潜在的代谢检查点。SARDH的表达可被肿瘤微环境中积累的肌氨酸诱导,在这一负反馈机制的影响下,加速甲基供体SAM的消耗并抑制甲基化活性,从而影响NF-κB信号通路的激活和T细胞的抗肿瘤功能状态(图 2)。本研究深入剖析了一碳代谢及SARDH在肿瘤微环境中受代谢环境影响,并通过代谢途径调控T细胞功能障碍的内在机制,为理解线粒体代谢在调节T细胞功能命运的作用提供了全新视角,并为优化现有的T细胞免疫疗法提供了重要的理论支撑。
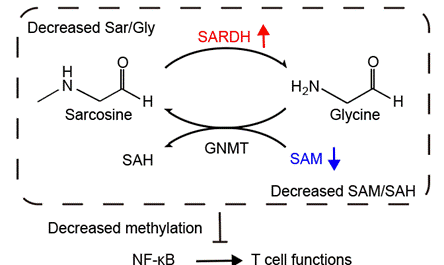
图 2 SARDH通过代谢通路影响T细胞功能的机制模型
前沿交叉学科研究院博士后司雯、重庆医科大学信息与肿瘤免疫研究院教授程斯进,北京大学生命科学学院何海崟为该论文的共同第一作者。BIOPIC教授/重庆医科大学校长张泽民院士、北京大学BIOPIC朱琳楠副研究员、北京大学肿瘤医院步召德教授,以及司雯博士为该论文的共同通讯作者。此外,原昌平国家实验室研究助理张玉、重庆医科大学信息与肿瘤免疫研究院苗玉辉副教授、北京大学生命科学学院易鼎程、北京大学黄岩谊课题组倪梦姣博士、北京大学肿瘤医院王安强副教授等人亦为该研究做出了重要贡献。该研究获得了国家重点研发计划、国家自然科学基金以及北京市科学技术委员会等项目的支持。
论文链接:
https://www.nature.com/articles/s41423-025-01331-5

张泽民,北京大学生物医学前沿创新中心主任,北京大学生命科学学院终身讲席教授,北大-清华生命科学联合中心高级研究员,长江学者,中国科学院院士。张泽民博士的学术经历包括南开大学、美国宾夕法尼亚州立大学和加州大学旧金山分校等。在2014年加入北大以前就任基因泰克/ 罗氏公司(Genentech/Roche)16余年,负责生物信息学和癌症基因组学研究,挖掘抗癌靶点。张泽民课题组致力于用前沿的生物信息和基因组学来解决癌症生物学中的核心问题,专注于研究肿瘤微环境的底层特征,发现了肿瘤在微环境水平的异质性和潜在规律,推进其在药物疗效预测和靶点发现中的应用。张泽民课题组的研究成果曾获得北京市自然科学一等奖、中国生命科学十大进展、中国生物信息十大进展(多次)。他也是多个国际顶尖杂志的编委,包括Cell, Cancer Cell, Cancer Discovery和Cell Research。
张泽民课题组目前主要的研究方向包括:(1)研究肿瘤微环境特别是肿瘤浸润免疫细胞的精确组成、相互作用以及功能状态,并鉴定影响这些细胞功能的调控基因;(2)研究肿瘤微环境的异质性、及其对癌症病人治疗的影响;(3)开发原创的生物信息学工具和数据库,来进行大数据的整合、分析和可视化。
来源:北京大学生物医学前沿创新中心