骨转移是恶性肿瘤最常见转移部位之一,其进展迅速预后极差,长期以来化疗、放疗、骨保护治疗等方式对于骨转移灶的疗效不够理想,仅能起到局部疼痛缓解作用。此外,尽管以免疫检查点阻断(immune checkpoint blockade, ICB)为代表的免疫疗法在实体肿瘤原发灶中取得突破,多项权威研究表明骨转移灶难以响应ICB治疗。与肿瘤原发灶相比,骨转移微环境更为复杂且具有更强的免疫抑制性。中性粒细胞是骨髓中占比最高的免疫细胞群体,然而目前对于中性粒细胞在骨转移微环境中所发挥的作用缺乏认知。因此,深入研究骨转移微环境免疫调控机制,在此基础上探索骨转移患者免疫治疗新策略,具有重要科学意义与迫切临床需求。
2025年8月7日,南京大学医学院附属鼓楼医院肿瘤中心魏嘉教授、南京大学模式动物研究所李颜教授、康奈尔大学医学院Taha Merghoub教授团队在Cancer Cell杂志上发表题为“CHI3L3⁺ immature neutrophils inhibit anti-tumor immunity and impede immune checkpoint blockade therapy in bone metastases”的研究论文,首次系统揭示了未成熟中性粒细胞(Immature neutrophils)在骨转移微环境中的关键作用,阐明其在介导免疫抑制并促进转移进展过程中的调控机制。同时,提出阻断DKK1重编程中性粒细胞发育状态联合应用PD-1单抗,是具有前景的骨转移联合免疫治疗新策略。

南京大学医学院附属鼓楼医院魏嘉教授、南京大学模式动物研究所李颜教授、康奈尔大学医学院Meyer Cancer Center主任Taha Merghoub教授为本文通讯作者。南京大学医学院附属鼓楼医院施涛博士、南京大学模式动物研究所刘威博士为本文共同第一作者。
原文链接:
https://doi.org/10.1016/j.ccell.2025.07.007
Part.1 发现现未成熟中性粒细胞构成骨转移微环境中主要粒细胞亚群
为探索骨转移微环境中的关键免疫治疗抵抗因素,研究人员首先通过质谱流式分析发现中性粒细胞在骨转移免疫微环境中占据最高比例,进一步动态流式分析发现与健康小鼠或供者骨髓中性粒细胞相比,骨转移灶中的未成熟中性粒细胞(Immature neutrophils)比例异常升高(进展终末期占比达80%)。体内中性粒细胞追踪实验结果也表明回输至骨转移小鼠的中性粒细胞成熟标志物表达下调(Ly6G⁺CD101⁺)。肿瘤相关中性粒细胞(Tumor-associated neutrophils, TANs)在肿瘤微环境中的重要作用近年来已受重视[1-4],然而现阶段针对TAN发育阶段对其功能所产生的影响仍然缺乏。本研究显示未成熟中性粒细胞的累积和免疫抑制是骨转移免疫难治的关键性原因。
Part.2 揭示DKK1-CKAP4-CHI3L3轴调控未成熟中性粒细胞功能状态
研究人员发现DKK1在骨转移患者中高表达,并且与患者较差的生存与治疗响应相关。魏嘉教授团队先前已报到DKK1诱导负性胃癌免疫微环境[5,6],因而研究人员继续探究DKK1对于中性粒细胞发育的影响。通过多种体外实验观察到DKK1与其受体CKAP4结合可以诱导中性粒细胞形成一种特殊的未成熟样功能状态(immature-like functional state),进而抑制CD8⁺ T细胞的抗肿瘤免疫效应。进一步对于小鼠骨转移灶单细胞转录组测序分析,发现Chil3基因在未成熟中性粒细胞特异性高表达,体外实验同样验证DKK1可诱导中性粒细胞的壳多糖酶-3样蛋白3(Chitinase-3-like protein 3, CHI3L3/YM1)表达和分泌。进一步通过多种体内外模型研究发现未成熟中性粒细胞所介导的免疫抑制效应依赖于CHI3L3途径。
Part.3 提出通过重编程中性粒细胞发育状态以控制骨转移进展
最后,研究人员探究靶向干预未成熟中性粒细胞作为骨转移免疫治疗策略的可行性。对于多种同源及免疫系统人源化(Human immune system, HIS)骨转移小鼠模型进行体内干预结果显示,给予mDKN-01(DKK1鼠源中和抗体)重编程中性粒细胞发育状态,联合PD-1单抗治疗介导骨转移显著消退,部分小鼠的骨转移病灶完全消失。值得关注的是,联合阻断DKK1和PD-1用于进展期胃食管腺癌患者治疗的II期临床试验(Distinguish trial, NCT04363801)于今年在J Clin Oncol杂志发表,中期结果显示该联合策略在DKK1高表达患者中的治疗响应率高达90%[7],魏嘉教授团队也受邀在J Clin Oncol同期发表评述文章[8]。而长期以来,骨转移晚期肿瘤患者缺乏有针对性的治疗策略,且新药临床试验也往往将骨转移患者排除在外。本研究基于充分的临床前结果,提出联合阻断DKK1与PD-1的骨转移免疫治疗新策略,通过重构中性粒细胞的发育状态来逆转抑制性的骨转移免疫微环境。
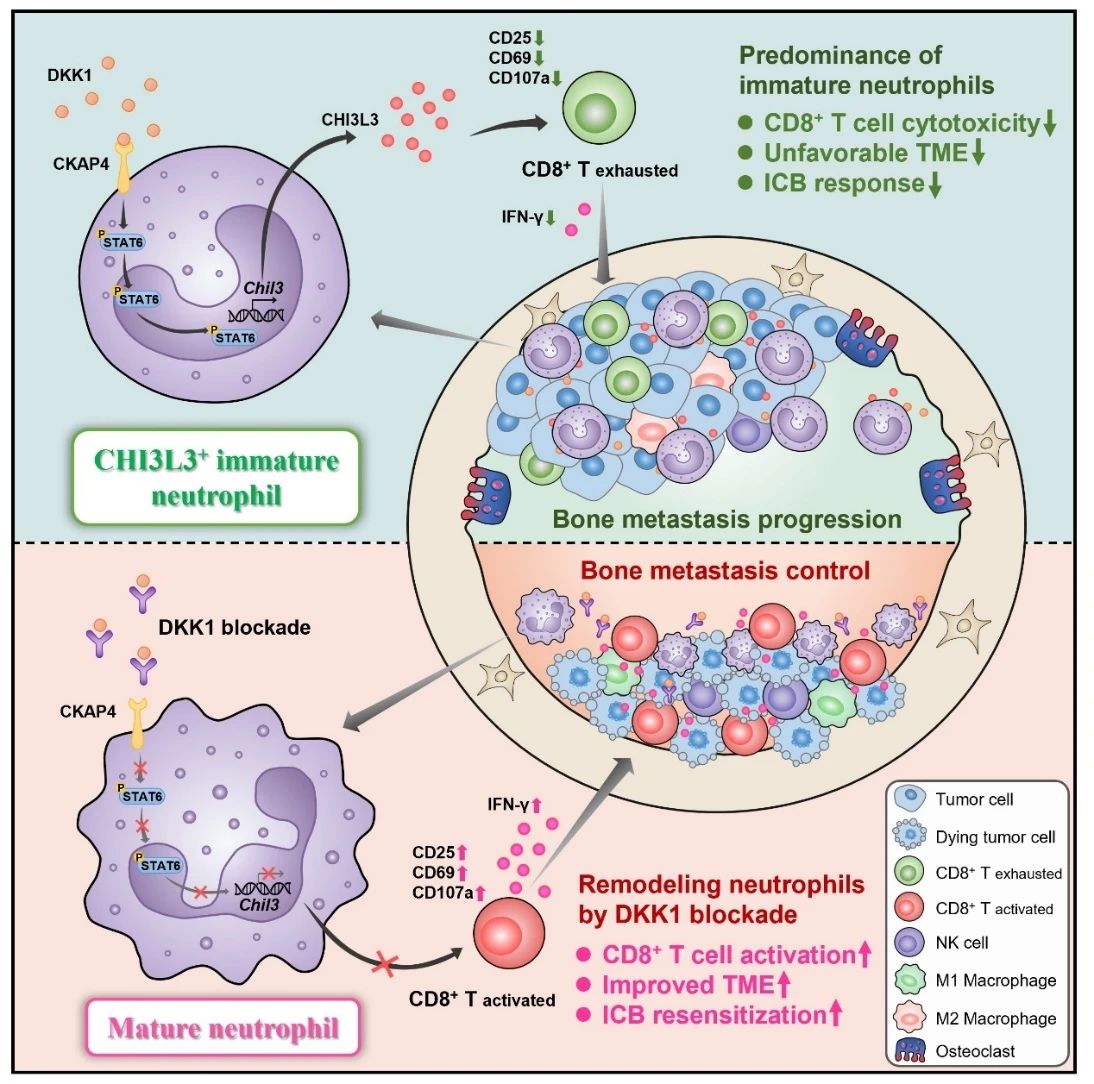
综上所述,本研究揭示了骨转移患者对免疫治疗响应不佳的关键原因,即骨转移微环境中性粒细胞处于未成熟功能状态以介导免疫抑制。同时,该研究提出联合阻断DKK1与PD-1的骨转移免疫治疗新方案,为骨转移患者带来治疗新希望。
此外,魏嘉/李颜教授等团队的有关中性粒细胞发育阶段的另一项研究“Human myelocyte and metamyelocyte-stage neutrophils suppress tumor immunity and promote cancer progression”近期于Cell Research杂志同步发表 (https://www.nature.com/articles/s41422-025-01145-0),该研究揭示了幼粒及晚幼粒(myelocyte and metamyelocyte,MC & MM)阶段中性粒细胞是天然具有免疫抑制性的人类中性粒细胞亚群,构建了支持人源中性粒细胞外周重建的新型人源化小鼠模型NCG-Gfi1-/-,提出诱导MC & MM阶段中性粒细胞转分化是提升患者疗效的肿瘤免疫治疗新策略。
通讯作者

魏嘉 教授
南京大学医学院附属鼓楼医院副院长,主任医师、教授、博士生导师,南京大学临床肿瘤研究所副所长,教育部“长江学者奖励计划”青年学者,科技部科技重大专项首席科学家。
研究方向为恶性肿瘤个体化免疫治疗,研究结果在Cancer Cell, Cell Res, J Clin Invest, Cell Rep Med, Nat Commun 等国际著名杂志上发表SCI文章140余篇。主持科技部“重大新药创制”科技重大专项1项、国家自然科学基金5项。
任eLife编辑,Gestrointestinal Tumors主编,BMC Cancer, Translational Cancer Research等多本SCI杂志编委;主编肿瘤个体化治疗英文专著两部、中文著作三部。相关研究获教育部科技进步奖、中华医学科技奖、江苏省科学技术进步奖等省部级奖励14项。

李颜 教授
南京大学教授、南京大学模式动物研究所所长、国家遗传工程小鼠资源库研究员,江苏省“双创人才“及”特聘教授”。
2020年获得江苏省”双创团队领军人才;2021年获得国家”优青”;2022年任模式动物研究所教工党组书记;2023年获得“南京大学青年五四奖章”。
主要研究成果发表在Cell,Nature Methods,Nature Cancer,Science Advances,ACS Nano等期刊。
现任国际人源化小鼠大会科学委员会成员、中国细胞生物学会免疫细胞分会委员、中国抗癌协会肿瘤免疫代谢分会委员、江苏省细胞与发育生物学学会理事、为PNAS,Nature Communications等期刊审稿人。

Taha Merghoub 教授
美国威尔康奈尔医学院(Weill Cornell Medicine)和纪念斯隆凯特琳癌症中心(Memorial Sloan Kettering Cancer Center, MSKCC)免疫学领域的知名科学家,现任威尔康奈尔医学院桑德拉和爱德华·迈耶癌症中心主任。
长期从事肿瘤免疫治疗相关研究。包括探索肿瘤免疫微环境的调控机制、开发新型免疫治疗策略以及研究免疫检查点抑制剂的耐药机制等。在Nature、Cell、Cancer Cell等期刊发文多篇。
参考文献:
1. Lad M, et al. Glioblastoma induces the recruitment and differentiation of dendritic-like "hybrid" neutrophils from skull bone marrow. Cancer Cell. 2024 Sep 9;42(9):1549-1569.e16.
2. Qian J, et al. A CXCR4 partial agonist improves immunotherapy by targeting immunosuppressive neutrophils and cancer-driven granulopoiesis. Cancer Cell. 2025 Jun 21:S1535-6108(25)00256-9.
3. Gungabeesoon J, et al. A neutrophil response linked to tumor control in immunotherapy. Cell. 2023 Mar 30;186(7):1448-1464.e20.
4. Hirschhorn D, et al. T cell immunotherapies engage neutrophils to eliminate tumor antigen escape variants. Cell. 2023 Mar 30;186(7):1432-1447.e17.
5. Shi T, et al. DKK1 Promotes Tumor Immune Evasion and Impedes Anti-PD-1 Treatment by Inducing Immunosuppressive Macrophages in Gastric Cancer. Cancer Immunol Res. 2022 Dec 2;10(12):1506-1524.
6. Zhang Y, et al. Combination therapy of DKK1 inhibition and NKG2D chimeric antigen receptor T cells for the treatment of gastric cancer. Cancer Sci. 2023 Jul;114(7):2798-2809.
7. Klempner SJ, et al.. DKN-01 in Combination With Tislelizumab and Chemotherapy as First-Line Therapy in Advanced Gastric or Gastroesophageal Junction Adenocarcinoma: DisTinGuish. J Clin Oncol. 2025 Jan 20;43(3):339-349.
8. Shi T, Wei J. Targeting DKK1 to Remodel the Tumor Microenvironment and Enhance Immune Checkpoint Blockade Therapy. J Clin Oncol. 2025 Jan 20;43(3):350-353.
来源:肿瘤界