近日,上海市肺科医院肿瘤科任胜祥教授、吴凤英教授团队与复旦大学基础医学院李飞教授团队合作在Molecular Cancer(IF: 33.9)在线发表了题为“IFITM3 enhances immunosensitivity via MHC-I regulation and is associated with the efficacy of anti-PD-1/-L1 therapy in SCLC”的研究论文,揭示了IFITM3通过调控MHC-I增强免疫治疗敏感性的重要机制,为小细胞肺癌的联合免疫治疗提供了新的潜在靶点。

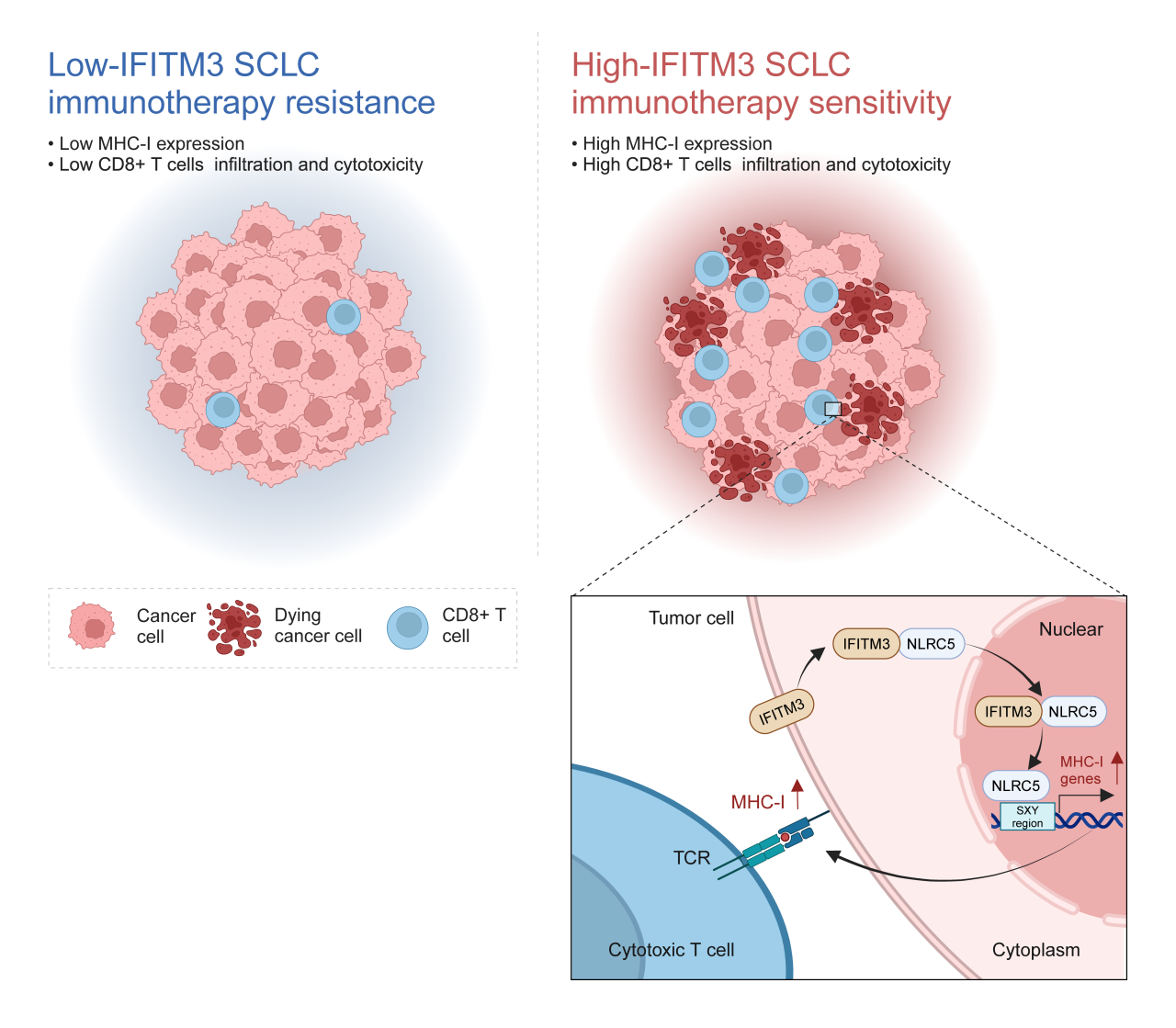
小细胞肺癌(SCLC)占所有肺癌的10%–15%,恶性程度高、进展迅速,预后极差。尽管近年来化疗联合免疫检查点抑制剂成为一线标准治疗方案,但多数患者的生存获益仍十分有限。已有研究表明,SCLC对免疫治疗不敏感的一个关键机制在于MHC-I分子的显著下调,导致肿瘤细胞难以被T细胞识别和清除。MHC-I的高表达目前被认为是预测ICIs疗效的最可靠标志物之一。恢复MHC-I表达被认为是提高SCLC免疫治疗敏感性的有效策略。然而,目前关于SCLC中MHC-I表达调控机制的研究仍较为匮乏,亟需深入探索。
本研究通过整合SCLC患者的单细胞RNA测序数据和多个真实世界bulk RNA测序队列,发现干扰素诱导跨膜蛋白3(IFITM3)表达与MHC-I呈显著正相关。体内外实验进一步证实,IFITM3过表达不仅可上调多种MHC-I相关基因,激活抗原呈递通路,还能增强CD8⁺ T细胞浸润与杀伤功能。在Impower-133临床队列中,IFITM3高表达显著延长了接受免疫联合化疗患者的无进展生存期(PFS),而在仅接受化疗的患者中未观察到这一趋势。此外,对42例一线免疫治疗SCLC患者的肿瘤样本进行免疫组化分析亦发现,IFITM3高表达(H-score)患者的治疗反应更佳。
在SCLC小鼠模型中,IFITM3过表达可显著增强PD-1抗体的抗肿瘤活性。值得一提的是,本研究还发现并验证了IFITM3的诱导剂——没食子酸乙酯(EG),其可有效上调IFITM3表达,从而增强SCLC的PD-1治疗效果。机制研究显示,IFITM3通过促进MHC-I转录激活因子NLRC5的表达及其核转位,进而显著提高MHC-I分子水平。
综上,IFITM3是调控MHC-I表达的关键因子,可作为SCLC免疫治疗反应的预测生物标志物,其诱导剂有望成为增强PD-1疗效的新型联合治疗策略,为SCLC免疫治疗带来新的突破。
同济大学附属上海市肺科医院肿瘤科任胜祥教授、吴凤英教授,复旦大学基础医学院李飞教授为本研究共同通讯作者。同济大学附属上海市肺科医院崔亚男博士、邱天羽博士、王家乐博士为本研究共同第一作者。
来源:上海市肺科医院官微