近日,陆军军医大学新桥医院、金凤实验室朱波教授团队与新加坡科技研究局(A*STAR)李启靖教授、上海市肺科医院苏春霞教授合作,在国际期刊Cancer Cell上发表了题为“Bone metastases diminish extraosseous response to checkpoint blockade immunotherapy through osteopontin-producing osteoclasts”的研究性论文。

免疫检查点抑制剂(ICB)的出现为晚期癌症患者带来了长期生存的希望,但临床响应率较低仍是其临床应用面临的严峻挑战。其中,伴随骨转移的患者ICB疗效尤其不佳,总体生存时间显著缩短。尽管骨转移在乳腺癌、前列腺癌、肺癌等高发癌症中发生率可高达70%,其导致免疫治疗耐药的机制长期不明,更缺乏针对性干预策略。这一临床“盲区”迫使患者陷入“有药难效”的困境。
朱波教授团队对超过2000例接受ICB治疗的转移性肿瘤患者(涵盖肺癌、乳腺癌等11类癌种)进行多中心回顾性分析,首次揭示一个关键临床现象:骨转移的存在会特异性削弱患者骨外病灶(如肺、肝、淋巴结)对ICB免疫治疗的反应性。在排除肿瘤负荷等混杂因素后,骨转移患者骨外病灶的客观缓解率降低10.8%,疾病进展风险升高57%~123%。影像学分析显示,骨转移患者接受ICB后,骨外肿瘤几乎无退缩(平均缩小比例<5%),而无骨转移组显著缩小。
为揭示这一现象背后的免疫学机制,研究者创新性的构建了双肿瘤模型:在小鼠胫骨植入骨转移灶(模拟临床骨转移),同时在皮下或肺部建立第二肿瘤(模拟骨外病灶)。当给予PD-L1抑制剂后:单纯皮下荷瘤的小鼠响应显著;而伴随骨转移时,同一只小鼠的骨外病灶(皮下/肺转移灶)几乎无响应,且T细胞浸润减少。通过血清回输实验证实,骨转移小鼠的血液携带“免疫抑制因子”,可降低无骨转移小鼠对ICB的治疗响应。这一结果复现了临床观察,为机制探索奠定基础。
通过定量蛋白质组学筛选与分析挖掘,研究者关注到骨微环境中的核心角色——破骨细胞。骨转移重塑破骨细胞功能,使其过量分泌骨桥蛋白(OPN):骨转移小鼠血清OPN水平升高约2倍,且70%来源于破骨细胞。OPN通过血液循环抵达骨外肿瘤,抑制CD8+ T细胞中关键亚群Tpex(干细胞样耗竭前体细胞)的分化,该细胞是响应ICB治疗的核心细胞群体。基因敲除实验证实,特异性清除破骨细胞的OPN后,骨外肿瘤的ICB治疗反应性显著恢复,Tpex细胞数量恢复至正常水平。
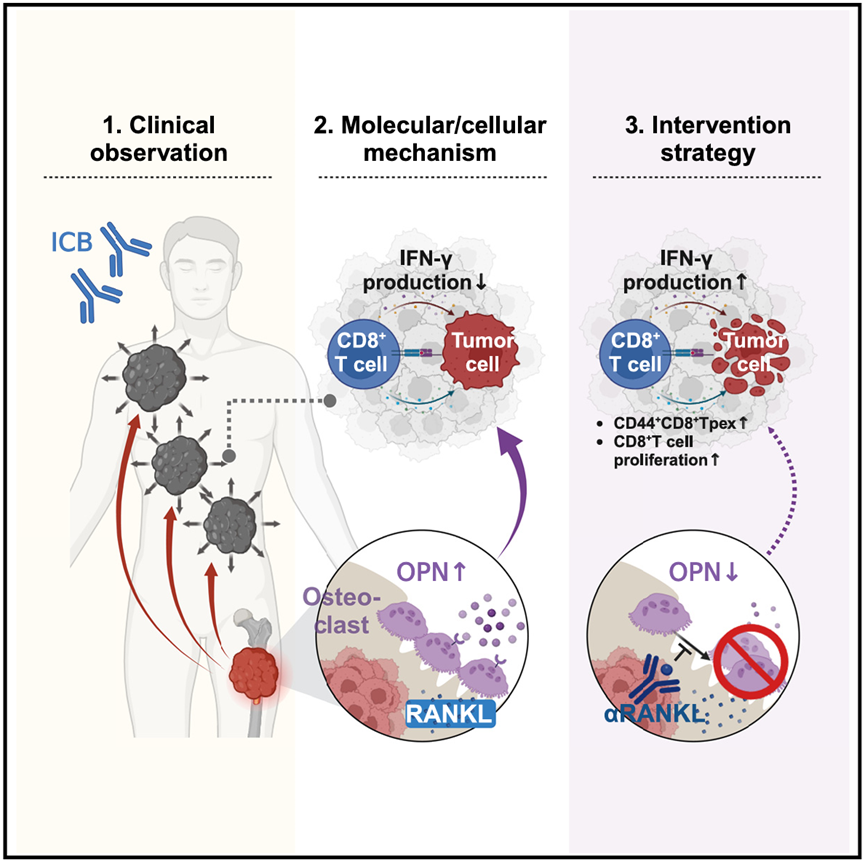
▲骨转移导致肿瘤免疫治疗耐药的机制示意图。
《Cancer Cell》是国际肿瘤学领域的顶尖期刊(影响因子44.5,JCR Q1区),由Cell Press出版社于2002年创刊,出版周期为月刊。该期刊专注于发表癌症生物学、肿瘤机制及临床转化研究的重大突破性成果,尤其强调对自然发生癌症的重要科学问题的深入探索,并优先刊载能推动癌症治疗、诊断或预防新范式建立的临床研究。其长期位列医学大类1区,细胞生物学和肿瘤学小类1区TOP期刊,是全球该领域科研人员发表前沿成果的权威平台。
来源:金凤实验室