2025年6月25日,复旦大学附属肿瘤医院邵志敏教授、江一舟教授团队在Nature Medicine上发表“Mobilizing antigen-presenting mast cells in anti-PD-1-refractory triple-negative breast cancer: a phase 2 trial”,该研究明确了肥大细胞在肿瘤免疫调控中的关键作用,提出了靶向抗原呈递肥大细胞(apMC)逆转抗PD-1耐药的策略,并强调了反向转化研究框架(临床→基础→临床)在精准免疫肿瘤学中的概念性进展,对临床治疗具有直接指导意义。

三阴性乳腺癌(TNBC)免疫疗法面临的核心挑战是确定抗程序性死亡-1(PD-1)耐药的新型机制衍生策略,并有效评估其在人体中的疗效和安全性。鉴于肿瘤微环境的复杂性,深入理解治疗应答的内在机制对于合理开发临床前和早期临床联合策略以克服抗PD-1耐药至关重要。
肥大细胞属于人体免疫细胞,主要位于黏膜等机体屏障组织,发挥重要的免疫调节功能。其传统角色是保护人体免受寄生虫感染以及诱发病理性过敏。既往研究发现,肥大细胞在不同肿瘤中的特征存在巨大差异,即便在同一种肿瘤中也存在明显不同的表型。例如,在鼻咽癌和结直肠癌中,肥大细胞可分泌肿瘤坏死因子(TNFs),表现出抗肿瘤表型;而在黑色素瘤中,肥大细胞与调节性T细胞共定位,导致预后不良。在乳腺癌中,肥大细胞浸润既被认为是有利预后因素,也被认为是不利因素。此外,其与免疫治疗应答的关联存在矛盾,部分研究将肥大细胞与不良结局相关,另一些研究则显示更高的缓解率。为了解决这些相互矛盾的观察结果,有必要摒弃肥大细胞为均质群体的观念,转而认识其异质性和多样化功能的新概念。此外,迫切需要探索肥大细胞异质性是否与抗PD-1应答相关,若相关,其仅是作为生物标志物,还是在该过程中起因果作用。
研究整合44例初治TNBC患者的单细胞转录组数据,揭示了患者体内肥大细胞异质性与PD-1阻断临床获益的关联。通过在484例TNBC患者中进行独立平行验证,发现乳腺组织中高丰度apMC与抗PD-1疗效增强相关。
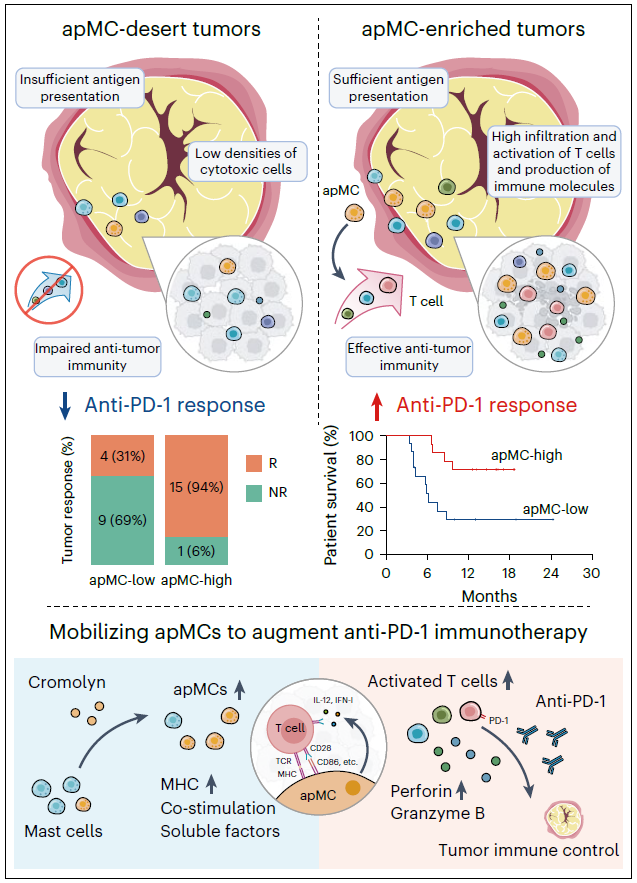
apMC与抗PD-1疗效增强相关
机制研究显示,apMC主要定位在三级淋巴结构内,可高效执行抗原呈递和交叉呈递,并表达共刺激分子。肥大细胞中抗原呈递机制的条件性缺失会削弱肿瘤反应性T细胞功能。研究发现临床常用的抗过敏药物色甘酸钠可激活apMC介导的T细胞免疫,并使肿瘤对PD-1阻断敏感。随后研究团队在抗PD-1难治/转移性TNBC女性患者中启动了Renaissance试验(NCT05076682)。Renaissance是一项2期开放标签平台试验,旨在评估机制导向免疫治疗方案在抗PD-1耐药转移性TNBC患者的疗效和安全性,为后续随机对照3期临床试验筛选有价值的疗法。具体来说,该试验对PD-1靶向治疗进展的转移性TNBC患者在继续抗PD-1抗体治疗的同时加用色甘酸钠,诱导或恢复抗肿瘤免疫应答。
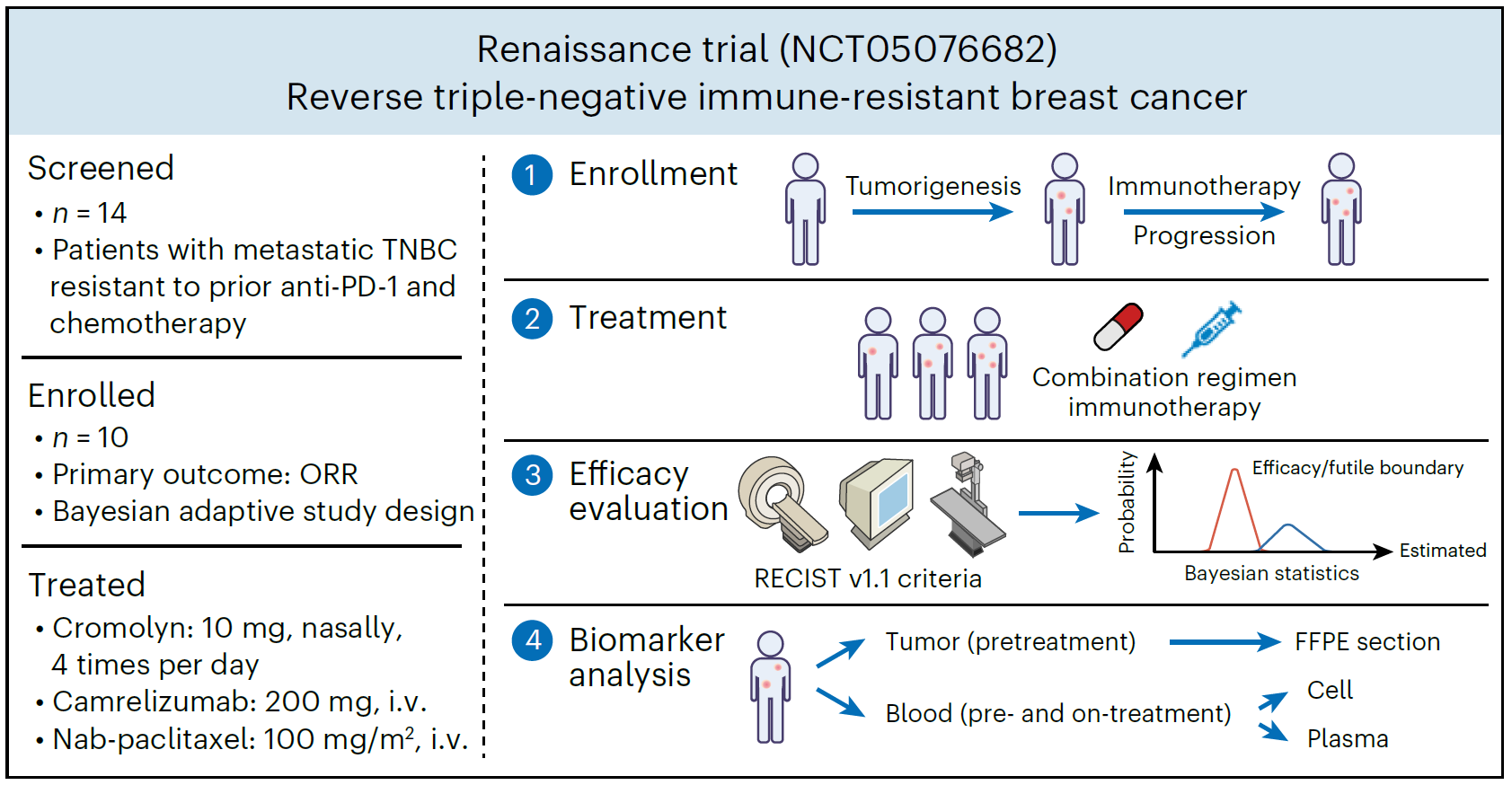
Renaissance试验设计
2022年6月29日-2023年2月21日,10例抗PD-1难治/转移性TNBC患者入组。研究结果显示,色甘酸钠联合PD-1抑制剂卡瑞利珠单抗为基础的免疫治疗方案,确认客观缓解率达50.0%(95%CI 23.7-76.3),相比经典方案提高近4倍,且安全性良好。
研究结果不仅支持进一步评估和开发apMC导向的治疗方案,还提供了一种以患者为导向的反向转化框架:(1)通过结合人体样本多模态分析与临床前实验,探究潜在的免疫逃逸靶点;(2)建立伦理方法验证临床前发现,并快速转化有前景的方案用于大规模临床试验。
来源:肿瘤界