HR-HPV 基因整合检测在子宫颈癌筛查应用的中国专家共识
中国优生科学协会阴道镜和宫颈病理学分会
中华医学会妇科肿瘤学分会
中华预防医学会肿瘤预防与控制专委会
中国妇幼健康研究会子宫颈癌防控研究专业委员会
基金项目:国家自然科学基金(82141106)
通信作者:
隋 龙 Email: suilong@fudan.edu.cn;
王临虹 Email: Linhong@chinawch.org.cn;
马 丁 Email: dma@tjh.tjmu.edu.cn;
魏丽惠 Email: weilhpku@163.com
【摘要】 我国子宫颈癌的发病率及死亡率仍不断上升,防控形势严峻。高危型人乳头瘤病毒(high-risk human papillomavirus, HR-HPV)基因整合入人基因组 DNA 序列是导致子宫颈癌发生的关键分子基础。随着精准诊疗理念的深入,合理应用新的高通量病毒基因整合检测技术有助于实现 HR-HPV 阳性者的精准分流和风险分层管理。本专家共识阐述 HR-HPV 基因整合在子宫颈癌发生发展中的作用及分子机制、相关检测方法及流程,并分别就 HR-HPV 基因整合检测在 HR-HPV 筛查异常者、联合筛查异常者、持续组织学低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion, LSIL/CIN1)、组织学高级别鳞状上皮内病变 / 子宫颈上皮内瘤变 2 级(high-grade squamous intraepithelial lesion, LSIL/CIN2)的随访检测、组织学 HSIL(CIN2, CIN3)治疗后复发风险评估给出推荐意见,旨在规范 HR-HPV 基因整合检测在子宫颈癌筛查中的应用,为临床医师在子宫颈癌筛查管理决策中提供参考,以期推动我国加速消除子宫颈癌。
【关键词】 子宫颈癌;HR-HPV 基因整合检测;精准分流;风险分层管理
子宫颈癌是最常见的妇科恶性肿瘤之一,严重危害女性健康。国家癌症中心报告我国 2022 年子宫颈癌发病例数增加到 15.07 万,死亡例数 5.57万 [1]。子宫颈癌防控形势十分严峻。高危型人乳头瘤病毒(high-risk human papillomavirus, HR-HPV)与宿主基因组基因整合是子宫颈细胞持续恶性增生过程中的关键分子基础,导致子宫颈上皮内病变向子宫颈癌恶性转化,因此 HR-HPV 在宿主细胞中的基因整合状态检测是评估子宫颈病变及预后的重要参数 [2]。为规范 HR-HPV 基因整合检测在子宫颈癌筛查管理中的临床应用,中国优生科学协会阴道镜和宫颈病理学分会、中华医学会妇科肿瘤学分会、中华预防医学会肿瘤预防与控制专委会、中国妇幼健康研究会子宫颈癌防控研究专业委员会组织专家经多次讨论后,制订本共识。
一、 HR-HPV 基因整合在子宫颈癌发生发展中的作用及分子机制
1. HR-HPV 基因整合在子宫颈癌的发生发展中的作用
HR-HPV 持续性感染是导致绝大多数子宫颈癌的最主要原因。而 HR-HPV 基因整合进入宿主子宫颈上皮细胞 DNA序列中是 HR-HPV 持续性感染的分子基础。通过 E6/E7 致癌蛋白的异常表达、基因组结构的重组及调控免疫逃逸及克隆演化等多种机制,引发细胞恶性转化并驱动肿瘤的进展。研究表明,HR-HPV 基因整合的发生率随着子宫颈病变的加重而逐渐升高:从子宫颈上皮内病变患者中的 53.8% 上升至子宫颈癌患者的 91.6%[3-5]。虽然 HR-HPV 基因整合可发生在人类基因组上的任何位置,但在染色体脆性位点、Alu 序列、基因外显子、内含子区域的 HR-HPV 基因整合危险性更高 [5],同时CCDC106[6]、MACROD2[7]、FHIT[8]、POU5F1B、KLF12、KLF5、LRP1B、LEPREL1、HMGA2、DLG2、SEMA3D[4] 等基因被发现是相对高频的基因整合位点。
2. HR-HPV 基因整合分子机制
HR-HPV 基因整合到宿主上皮细胞基因组的具体机制包括:① 首先,在 HR-HPV 基因整合过程中,早期基因启动子起抑制作用的 E2 基因发生断裂失活,致癌蛋白 E6 和 E7 充分释放过表达 [9]。E6 蛋白介导重要的肿瘤抑制因子 p53 失活而阻断细胞的凋亡通路,E7 蛋白破坏 pRb 家族的功能使细胞周期调控失衡 [10]。这些改变导致子宫颈上皮细胞凋亡失控、无限增殖,最终引发细胞的恶性转化,并进一步加剧基因组的不稳定性。② 其次,HR-HPV 基因整合还可能通过调节免疫逃逸通路,促进 HR-HPV 基因整合的细胞恶性转化。转录活跃型 HR-HPV 基因整合可能诱导肿瘤细胞通过 PVR-TIGIT通路来逃避宿主免疫监视,从而降低 T 细胞对肿瘤细胞的杀伤效应并干扰宿主的免疫反应来实现免疫逃避 [11]。③ HR-HPV 基因整合位点易于发生断裂与重排,导致宿主染色体的结构畸变和数目异常(如异位、缺失及扩增),最终引发宿主基因组的不稳定性 [12]。特别是当 HR-HPV 基因整合发生于宿主基因组中的功能性基因区域时,可导致相关基因显著改变或失活,促进肿瘤的发生与进展 [13]。
二、 HR-HPV 基因整合的检测方法及流程
二代测序技术(next generation sequencing, NGS) 是分子诊断划时代的进步,也为实现子宫颈癌筛查风险分层精准管理提供可能。由于 HR-HPV 基因在人类基因组上的基因整合具有低丰度和随机性,仅依靠全基因组 NGS 难以满足低成本检测需求。高通量病毒基因整合检测(high-throughput viral integration detection, HIVID)采用特定的杂交捕获技术,特异性地富集含有病毒序列的 DNA 片段,再进行高通量测序对病毒基因整合核酸序列进行检测。该技术可以显著提高检测的灵敏度和特异性,尤其适用于病毒基因整合频率较低的情况。HIVID 技术可在单碱基水平对HR-HPV 在人基因组上的基因整合位置进行分析,可满足临床上准确分析和高性价比的需求。相关流程如下:① 样本采集:通过常规子宫颈脱落细胞采集方法,按照国家药监局考核试剂推荐的配套一次性使用宫颈采样拭子和细胞保存液,4 ~ 37℃保存 5 天内送检,2 ~ 8 ℃保存不超过 6 个月。② 基因组 DNA 提取:提取脱落细胞的基因组 DNA,测定 DNA 的浓度和纯度。③ 预文库建库:将基因组 DNA进行片段化处理,扩增纯化形成预文库。④ 靶序列富集:将 HR-HPV 基因组全长的探针混合制备探针池,将探针池与预文库杂交富集。⑤ 高通量测序:利用 NGS 平台对富集文库进行双端测序。⑥ 生物信息学分析:分析时将同时包含 HR-HPV 及人类基因组序列的测序片段计为一个基因整合 reads,并对基因整合位点在人基因组上的位置进行注释,出具基因整合检测报告。
三、 子宫颈癌筛查管理的困境
由于中国人口众多、经济发展不平衡、临床医师规范化培训不足等多方面原因,国内子宫颈癌筛查管理主要存在以下问题。
1. HR-HPV 阳性人群数量多:HR-HPV 核酸检测作为子宫颈癌的主要初筛方法,灵敏性高,特异性低,筛查出的大量的 HR-HPV 阳性人群面临着如何精准分流的问题[14]。我国 30~ 64 岁女性人口约 3.6 亿,参考 15.0% HR-HPV感染率,预计筛查出 5 400 万 HR-HPV 阳性人群,而每年子宫颈癌发生率约为 11-15 万,更多的是仅为 HR-HPV 感染的人群,该人群普遍存在焦虑和恐癌情绪,给家庭和社会都带来沉重的负担 [15]。如何更好的进行精准风险分层及管理,是目前筛查工作中亟需解决的难题。
2. 细胞学检查质控不足:细胞学检查作为子宫颈癌的初筛方法之一。由于我国细胞学医师和技术人员匮乏,检查水平参差不齐,质量控制不足,检查敏感度低,假阴性率高 [16-17],细胞学检查假阴性结果变化较大(9.8%~65%)[18]。一项 39家医院病理科细胞学检查发现二甲医院优良率 60%,三甲医院优良率 84.6%[19]。因此在子宫颈癌筛查管理中,亟需新的分流和风险分层技术,以期实现精准管理。
3. 阴道镜检查质量不齐且转诊能力有限:子宫颈癌三阶梯筛查路径中,阴道镜检查是重要环节。在我国,阴道镜检查在三甲医院和基层医院均已广泛开展。目前经规范化培训的阴道镜专科医师数量有限,难以满足临床需求。而未经规范化培训的阴道镜专科医师进行阴道镜检查会影响患者的依从性 [20]。由于阴道镜检查质量与水平参差不齐 [21],漏诊率高达 13% ~ 69%[22]。特别是 3 型转化区和绝经后人群成为漏诊的高风险人群。
4. 子宫颈上皮内瘤变 2 级(cervical intraepithelial neoplasia, CIN2)过度治疗:在一项关于组织学为高级别鳞状上皮内病变 /CIN2(high-grade squamous intraepithelial lesion, HSIL/CIN2)的回顾性研究中,50% 患者两年内病变逆转,32% 持续,仅有 18% 进展为 CIN3 及以上;小于 30 岁的年轻女性自然消退率更高,60% 逆转,23% 持续,仅有 11% 进展为 CIN3 及以上 [23]。尽管子宫颈切除性手术治疗不影响妊娠率,但会增加流产和早产风险 [24];此外,增加胎膜早破、绒毛膜羊膜炎,以及新生儿相关并发症,其发生率随着锥切深度的增加而上升 [25-26]。子宫颈切除性手术的另一主要并发症为子宫颈管狭窄,发生率为 3.4%~32.7%,特别是绝经后女性,术后子宫颈管狭窄率更高,严重影响术后随访管理 [27]。
四、 HR-HPV 基因整合检测的临床应用
根据美国阴道镜与子宫颈病理学会(American Society of Colposcopy and Cervical Pathology, ASCCP)“同等风险,同等管理”的原则 [28],本指南推荐以 CIN 3 及以上病变(CIN 3+)作为主要临床终点。
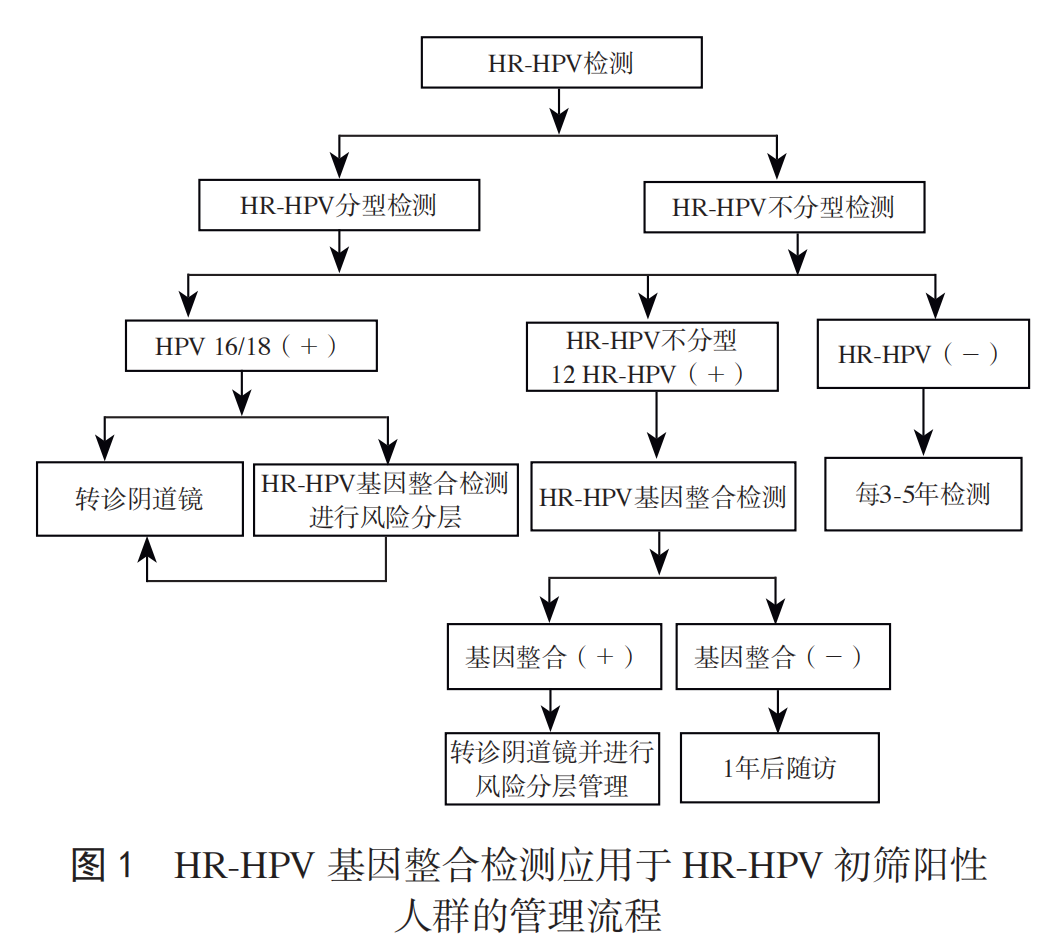
1. HR-HPV 基因整合检测用于 HR-HPV 阳性人群分流及风险分层管理
一项纳入 1.2 万例前瞻性人群的队列研究,其中 4 611例完成 5 年随访,结果显示,HR-HPV 基因整合检测与细胞学检查相比,检出 CIN3+ 的敏感性相似,但特异性更高,且前者可降低 60% 的阴道镜转诊率,并且具有更好的卫生经济学获益 [29]。另一项纳入 1 393 例 HR-HPV 感染的医院机会性筛查人群的队列研究也显示 [30],HR-HPV 基因整合检测在检出 CIN3+ 的敏感性同细胞学检查,但特异性高于细胞学。
HR-HPV 基因整合检测直接针对子宫颈癌发病的关键分子变化,有助于实现 HR-HPV 阳性人群的精准风险分层。在 HR-HPV 阳性患者中,基因整合阳性患者的 CIN3+ 即时风险为 48.6%,占总人群的 9.9%[30]。其中,HPV 16/18 型在所有型别中致癌风险最高,基因整合阳性患者的 CIN3+即时风险为 56.5%[30]。按照 2019 ASCCP 的风险管理模式,CIN3+ 即时风险在 25%~59% 之间的人群因风险较高,建议可接受阴道镜检查或快速治疗 [28]。因此,对于基因整合阳性尤其是 HPV 16/18 型患者,临床医师应高度重视,进行全面的阴道镜检查、多点活检及子宫颈管搔刮术(endocervical curettage, ECC)充分的诊疗干预和密切的随访监测;而基因整合阴性患者占 HR-HPV 阳性人群的 90.1%,CIN3+ 即时风险为 2.2%,低于 ASCCP 建议的阴道镜转诊阈值(4%),且一年后疾病进展风险远低于基因整合阳性的女性,可大幅度减少阴道镜的转诊率,提高阴道镜检查依从性和随访率。HPV 16/18 初筛阳性,基因整合检测阳性且阴道镜活检阴性者,如细胞学为不能排除高级别鳞状上皮内病变的不典型鳞状细胞(atypical squamous cells-cannot exclude HSIL, ASC-H)及以上,可考虑诊断性锥切术。基因整合阴性患者,进展风险较低,可以辅助医师评估风险,减轻患者焦虑心理,避免过度治疗。
推荐意见:① HR-HPV 初筛不分型阳性:推荐 HR-HPV基因整合检测分流。基因整合阳性患者为高风险人群,转诊阴道镜并进行风险分层管理;基因整合阴性,1 年后随访。② HR-HPV 16/18 初筛阳性者,直接转诊阴道镜,或同时行HR-HPV 基因整合检测进行风险分层管理,基因整合阳性为极高风险人群,应高度重视;HR-HPV 其他 12 型(12 HR-HPV)初筛阳性且基因整合阳性者,为高风险人群,转诊阴道镜并进行风险分层管理,基因整合阴性,1 年随访。见图 1。
2. HR-HPV 基因整合检测用于 HR-HPV 检测联合细胞学筛查异常人群分流及风险分层管理
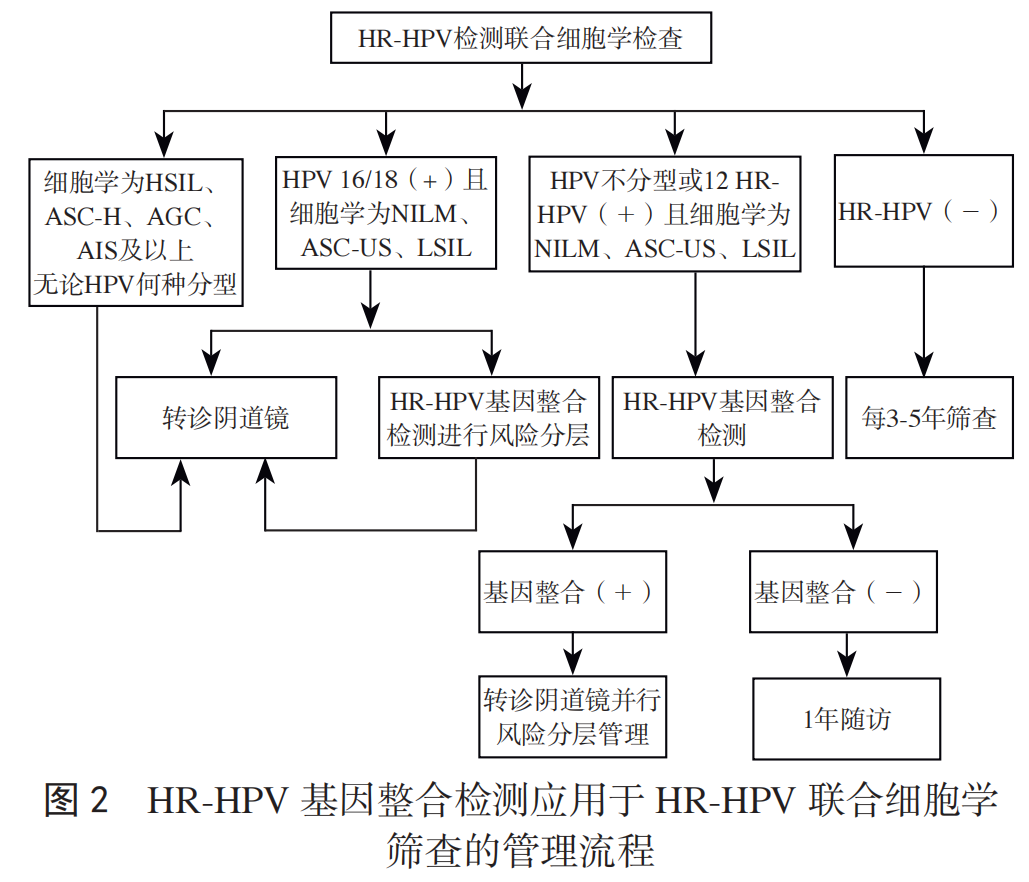
细胞学检查联合 HR-HPV 检测是子宫颈癌筛查的推荐方法之一 [31]。细胞学为未见上皮内病变或恶性细胞(negative for intraepithelial lesion or malignancy, NILM)在筛查人群占比绝大多数,联合筛查 HR-HPV 阳性,其 CIN3+的即时风险<4%,无需转诊阴道镜;但 HR-HPV 基因整合阳性时,CIN3+ 的即时风险上升至 26.9%,需转诊阴道镜,可有效减少部分 CIN3+ 漏诊。细胞学未明确诊断意义的不典型鳞状细胞(atypical squamous cells of undetermined significance, ASC-US)、低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion, LSIL)患者占总筛查异常患者中较大部分(KPNC 队列中筛查异常占比 42.8%)[30, 32],CIN3+ 即时风险分别为 4.45% 和 4.27%,略高于阴道镜转诊阈值,因此大量患者需转诊阴道镜。细胞学 ASC-US、LSIL 联合筛查 HR-HPV 阳性患者,若 HR-HPV 基因整合阳性,CIN3+ 的即时风险上升为 65.6% 和 71.8%,均为高风险人群,临床医生应给予全面的阴道镜检查、多点活检及ECC、充分的诊疗干预和密切的随访监测;HR-HPV 基因整合阴性,ASC-US、LSIL 的 CIN3+ 即时风险下降为 1.3%和 3.6%,均低于阴道镜转诊阈值,建议一年后复查 [30]。因此,HR-HPV 基因整合检测实现精准风险分层管理,可减少联合筛查后大量异常人群的阴道镜转诊率,避免过度诊疗,同时最大程度减少漏诊。
推荐意见:① HPV 不分型,细胞学为 NILM、ASC-US、LSIL:推荐 HR-HPV 基因整合检测分流,整合阳性转 诊阴道镜,整合阴性 12 个月随访。② HPV 分型,细胞学 为 NILM、ASC-US、LSIL:HR-HPV16/18 阳性,转诊阴道镜,或同时行 HR-HPV 基因整合检测风险分层;其他 12 HR-HPV 阳性者,基因整合阳性转诊阴道镜检查风险分层管理,基因整合阴性者推荐 1 年随访,见图 2。
3. HR-HPV 基因整合检测在持续组织学 LSIL(CIN1)患者中的管理应用
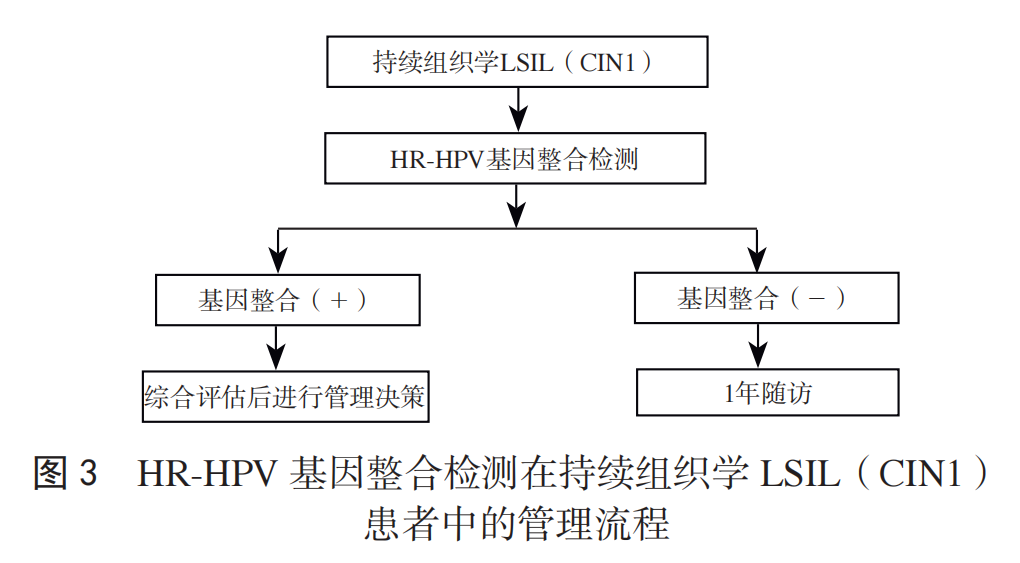
目前临床对持续组织学 LSIL(CIN1)患者的管理存在无法识别哪些进展或消退,对 3 型转化区的病变诊断困难等因素,导致部分组织学 HSIL(CIN2,CIN3)漏诊。一项来自华中科技大学同济医学院附属同济医院的前瞻性队列研究,对 2020 年 6 月至 2022 年 8 月期间 1 297 例 21~75岁女性进行 HPV 基因整合检测。最终 181 例 HR-HPV 基因整合检测阳性者完成一年随访,其中 58 例经组织学活检病理确诊≤LSIL(CIN1),整合位点消退和转换 46 例,均未进展;同一位点持续整合者 12 例,5 例进展为 HSIL(CIN2、CIN3)。因此,对于持续组织学 LSIL(CIN1)患者进行HR-HPV 基因整合检测,可降低过度治疗并减少组织学HSIL(CIN2, CIN3)的漏诊。
推荐意见:对于持续组织学 LSIL(CIN1)患者,推荐补充进行 HR-HPV 基因整合检测,用于患者的风险分层管理。基因整合阳性的组织学 LSIL(CIN1)者为高风险人群,综合评估后做出管理决策,进行相应治疗;基因整合阴性者为低风险人群,建议 1 年后随访,见图 3。
4. HR-HPV 基因整合检测在组织学 HSIL(CIN2)治疗或随访的指导作用
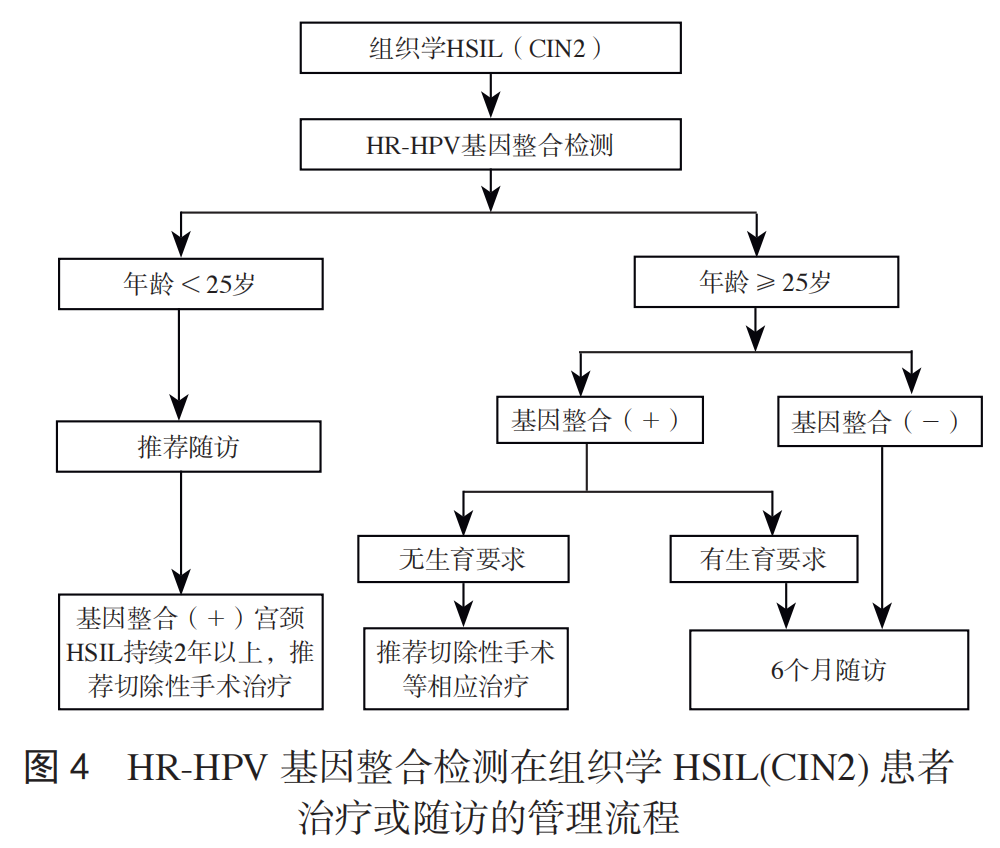
目前对组织学 HSIL(CIN2)有生育需求的人群如符合随访条件,建议保守观察。然而需要更精准的方式对这一人群进行风险分层。一项待发表的研究显示, 98 例 CIN2 女性在一年随访结束后,56.25%HPV 整合阳性的患者病变持续或进展,43.75% 患者病变消退,而 HPV 整合阴性的患者中,仅 17.28% 病变持续或进展,82.72% 病变消退。另一项正在开展的多中心研究中,36 例 CIN2 患者已完成 6~12 个月随访,其中 3 例基因整合阳性,病灶维持未消退;33 例基因整合阴性患者中,12 例(36.4%)出现病灶消退,8 例(24.2%)HR-HPV 转阴。因此基因整合阳性的组织学 HSIL(CIN2)患者为高风险人群,应积极治疗;基因整合阴性的组织学 HSIL(CIN2)患者为低风险人群,应结合患者年龄、细胞学结果、阴道镜评估和生育需求等因素,酌情考虑相对保守的处置方式如 6 个月随访观察。
推荐意见:对于组织学 HSIL(CIN2)患者,推荐进行HR-HPV 基因整合检测,结合年龄进行分层管理,见图 4。① 年龄<25 岁,无论基因整合检测结果,均推荐进行随访;基因整合阳性,如果组织学 HSIL(CIN2)持续 2 年及以上,推荐进行切除性手术等相应治疗。② 年龄≥25 岁,有生育要求,基因整合阳性,可考虑 6 个月随访观察,但鳞柱交界不可见,不建议观察;无生育要求,基因整合阳性,推荐进行切除性手术等相应治疗。基因整合阴性,无论有无生育要求,均推荐进行随访,见图 4。
5. HR-HPV 基因整合检测在组织学 HSIL(CIN2, CIN3)治疗后复发风险评估的管理应用
组织学 HSIL(CIN3)患者长期随访中 30% 进展为子宫颈浸润癌,因此推荐切除性手术治疗。术后 6 个月常规进行 HR-HPV 检测或 HR-HPV 联合细胞学随访检测,HR-HPV检测阴性者,推荐间隔 12 个月的检测。连续 3 次阴性者,推荐间隔 3 年、持续至少 25 年随访;HR-HPV 检测阳性者,需进行阴道镜检查。虽然 HR-HPV 检测预测病变复发或残留敏感性高,但是特异性低,且术后 HR-HPV 自然转阴时间较长(中位数 9 个月)[33-34],因此较多患者在治疗后需反复接受阴道镜检查,给患者带来心理负担,加重焦虑情绪。HR-HPV 基因整合检测技术可以提供一个有效的分层管理手段。一项临床研究显示,HR-HPV 基因整合阳性患者复发率为 10.7%,明显高于阴性患者(1.1%)。HR-HPV 基因整合对预测组织学 HSIL(CIN2, CIN3)治疗后复发或残留病灶的敏感性为 100%,特异性与阳性预测值(98%, 85.7%)均显著优于 HR-HPV 核酸检测(82%, 40%)[34]。另一项回顾性研究共纳入 73 例 HSIL 术后 HR-HPV 阳性的患者,其中 10例(13.7%)检测到基因整合阳性。整合阳性女性在 1 年内的残留或复发 CIN 率显著高于整合阴性组(40.0% vs. 11.4%, P =0.028)。进一步的回归分析显示,HPV 整合是残留或复发病变的独立风险因素(OR=3.917, P =0.048)[35]。因此,术后 6 个月复查 HR-HPV 阳性患者,建议行 HR-HPV 基因整合检测;基因整合阳性患者建议立即进行阴道镜检查,基因整合阴性患者可推迟阴道镜检查至术后 12 个月,减少不必要的阴道镜检查。(参考图 2 联合筛查阳性分流示意图)
推荐意见:组织学 HSIL(CIN2, CIN3)治疗后 6 个月随访 HR-HPV 阳性患者,建议行 HR-HPV 基因整合检测。基因整合阳性患者为高风险人群,建议转诊阴道镜。基因整合检查阴性、且细胞学 NILM、ASC-US、LSIL 为低风险人群,建议术后 1 年复查。
五、 未来与展望
随着技术的进步和发展,子宫颈癌筛查技术也在逐步更新。HR-HPV 基因整合导致子宫颈癌发生发展的观点已得到国际专家和专业学术组织的认可,该检测技术对于子宫颈癌筛查异常患者的风险分层、全程管理具有临床意义。本共识旨在为 HR-HPV 基因整合检测技术的临床应用提供专家指导建议。所有临床建议均基于现有循证学证据和全体专家讨论审查后制定,期望本共识可对各级医疗机构和医师提供临床参考和帮助。HR-HPV 基因整合宿主细胞到子宫颈癌的发生是一个复杂的多步骤过程,涉及到宿主细胞的其他基因变化、免疫状态等多种因素,由于自身强大的免疫监视机制,部分 HR-HPV 基因整合程度较低的状态可发生自行消退,仍需要随访观察,无法提前预判。HR-HPV 基因整合检测作为一项新的子宫颈癌筛查管理技术应用于临床工作中,仍然面临着诸多挑战,需要推进技术成果转化成试剂盒,在获得国家食品和药品监督管理局批准可用于子宫颈癌筛查阳性人群分流的预期用途后使用。而且未来仍需要更多临床随访数据证明技术的可行性,以及在不同场景下应用时结果的准确性和稳定性,来不断完善本共识及专家建议。
编写专家组成员
编写专家组学术顾问
魏丽惠 北京大学人民医院
马 丁 华中科技大学同济医学院附属同济医院
孔北华 山东大学齐鲁医学院附属齐鲁医院
编写专家组组长
隋 龙 复旦大学附属妇产科医院
赵方辉 中国医学科学院肿瘤医院
王临虹 中国疾病预防控制中心
主要执笔专家
丛 青 复旦大学附属妇产科医院
黄晓园 华中科技大学同济医学院附属同济医院
胡 婷 华中科技大学同济医学院附属同济医院
周 虎 中国科学技术大学附属第一医院
编写专家组成员
狄 文 上海交通大学医学院附属仁济医院
汪 辉 浙江大学医学院附属妇产科医院
王新宇 浙江大学医学院附属第一医院
吴 鸣 北京协和医院
郭瑞霞 郑州大学第一附属医院
孙蓬明 福建省妇幼保健院
郑 莹 四川大学华西第二医院
任琛琛 郑州大学第三附属医院
王 薇 上海市第一妇婴保健院
宋 坤 山东大学齐鲁医院
邱丽华 上海交通大学医学院附属仁济医院
吴 丹 上海交通大学医学院附属国际和平妇幼保健院
李 芳 同济大学附属东方医院
吴 鹏 华中科技大学同济医学院附属协和医院
胡 争 武汉大学中南医院
周 颖 中国科学技术大学附属第一医院
梁海燕 中日友好医院
李明珠 北京大学人民医院
周怀君 南京鼓楼医院
周家德 安徽医科大学第一附属医院
余 楠 华中科技大学同济医学院附属同济医院
陈 炎 安徽医科大学附属第一医院
编写组秘书
俞 弋 复旦大学附属妇产科医院
罗凌霄 复旦大学附属妇产科医院
参考文献略