为了响应《“健康中国2030”规划纲要》,实现我国全民消化肿瘤早诊早治,《肿瘤界》设立“齐力荟聚-消化肿瘤频道”,聚焦消化肿瘤患者的诊断治疗。旨在报道国内前瞻性、创新性和高学术水平的关于消化道肿瘤防治的临床应用和基础研究,把握学术发展动向,促进学术交流,整体提高国内消化肿瘤防治的临床与研究水平,结合国内研究特色,以及国内临床规范制度,推动消化肿瘤防治的进步,普及推广临床规范化诊疗。
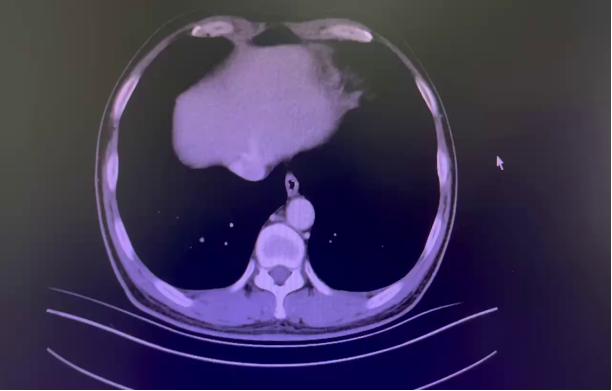
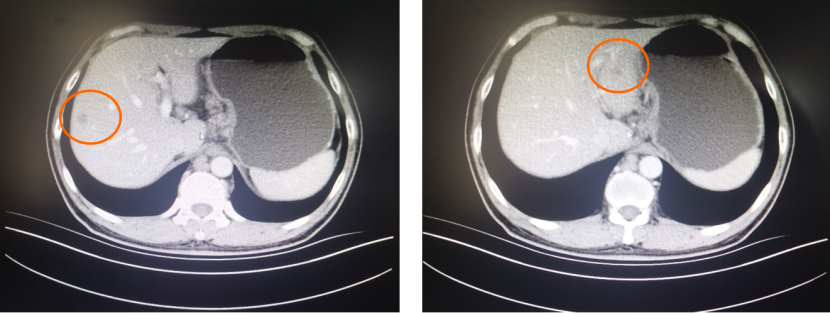
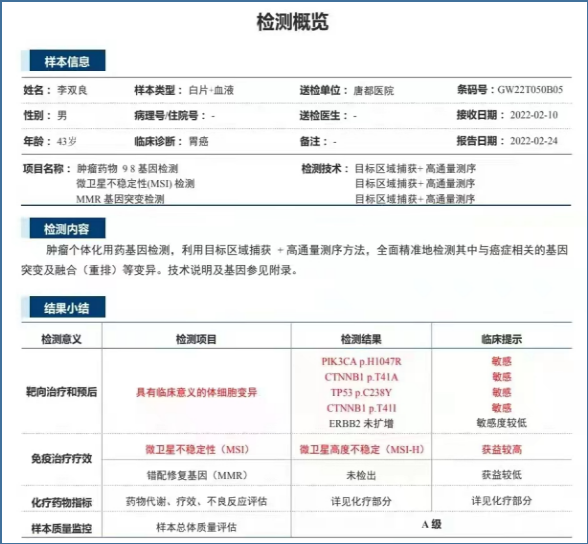
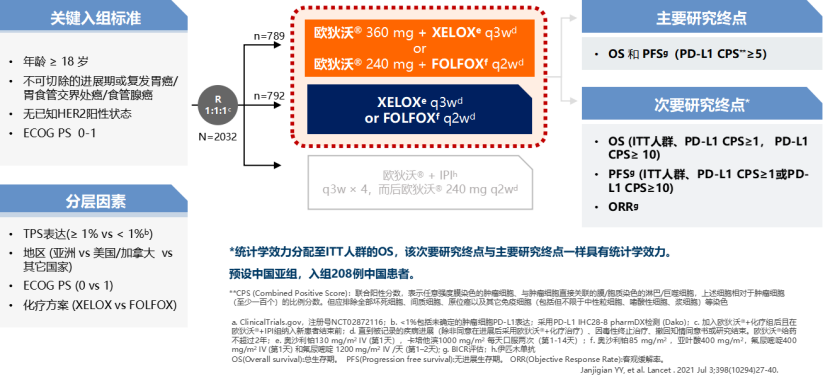
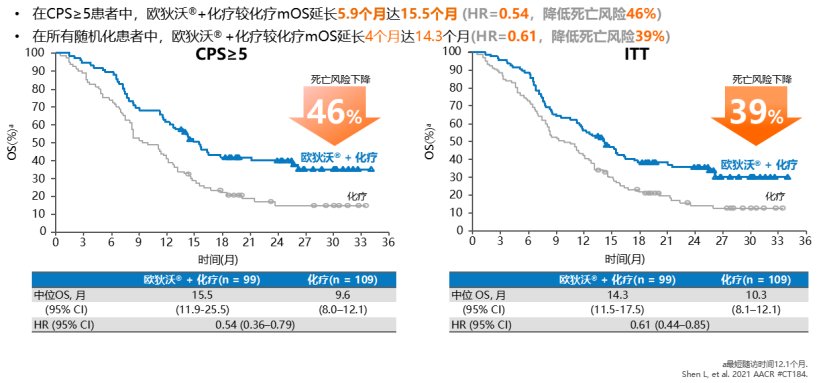
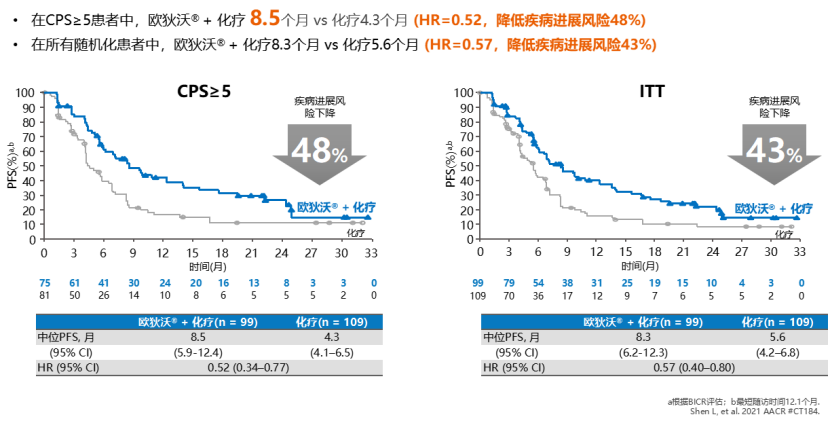
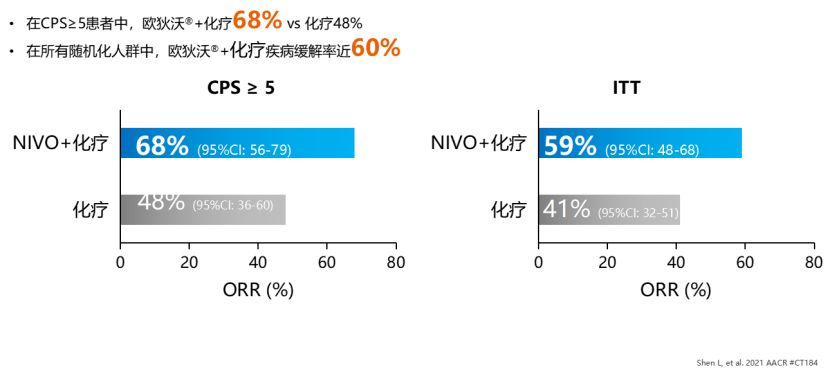
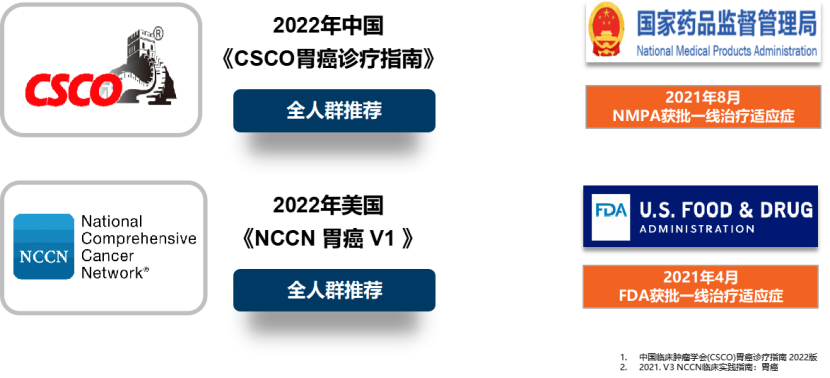
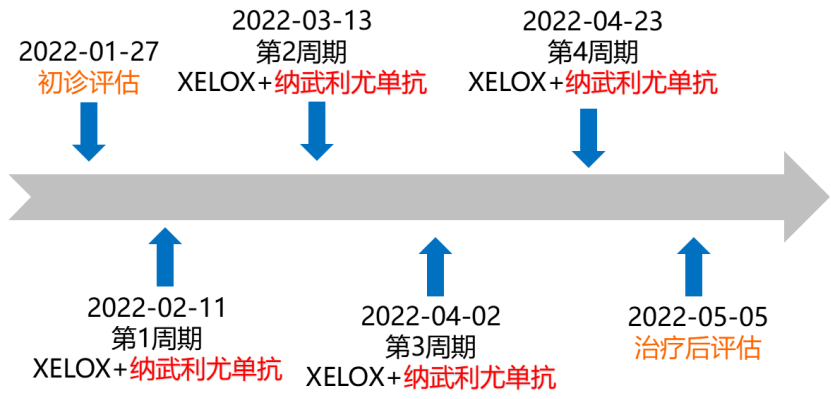
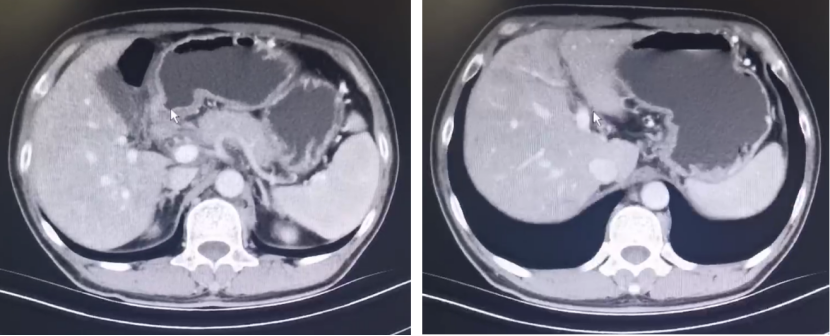
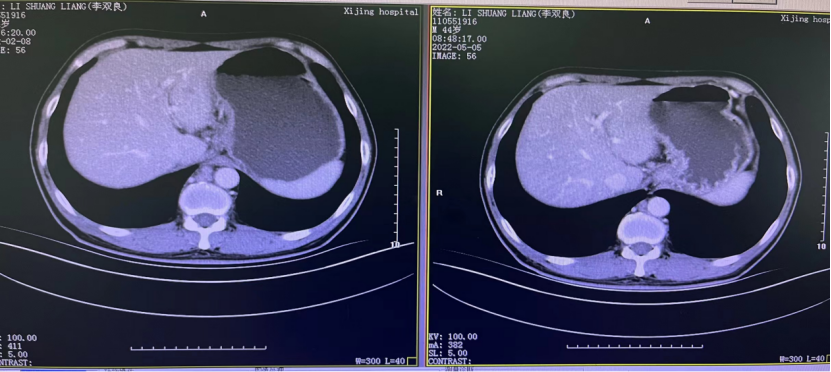
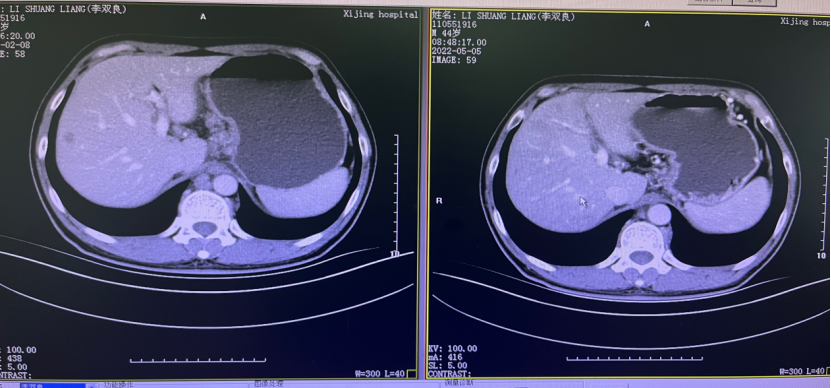
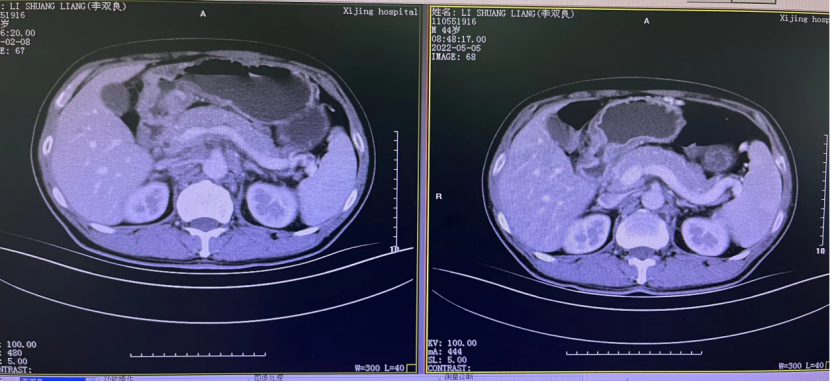
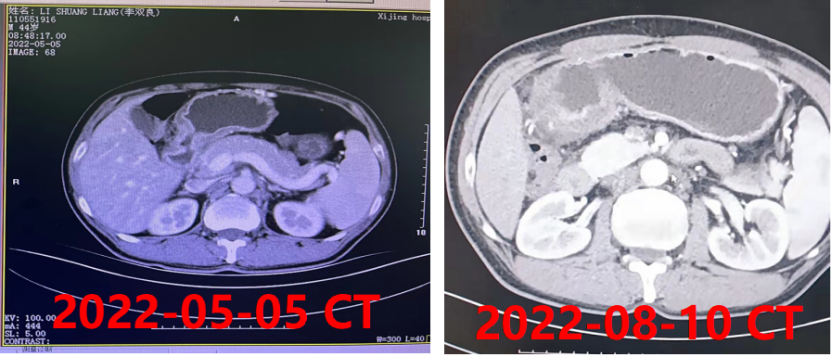
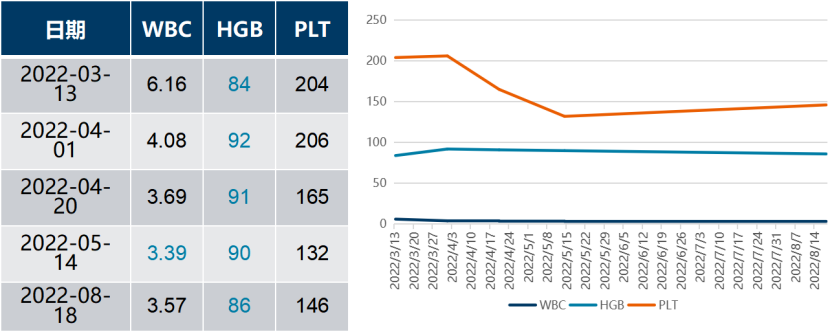
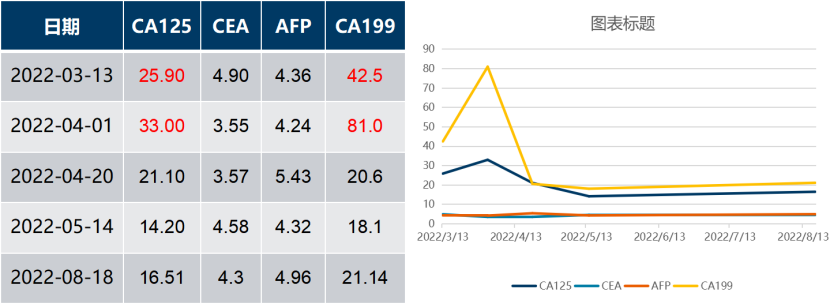
一 专家访谈 专家简介 季刚 教授 空军军医大学西京医院消化外科主任 主任医师、教授、医学博士、博士研究生导师 美国佛罗里达大学访问学者 中国抗癌协会理事 中国抗癌协会肿瘤胃肠病学专业委员会主任委员 中国医师协会整合医学分会胃肠外科学专业委员会常务委员兼秘书 中华医学会外科学分会甲状腺及代谢学组委员 教育部长江学者特聘教授 “新世纪优秀人才”、空军“高层次人才”、军队创新人才工程学科拔尖人才 陕西省创新团队负责人、空军军医大学“凌云工程”创新团队负责人、“陕西省科技新星” 陕西省特支计划科技创新领军人才、中青年科技创新领军人才 获中国抗癌协会科技奖一等奖1项(第一),陕西省科学技术进步二等奖1项(第一),陕西省第十一届青年科技奖1项,中华医学会青年科技一等奖,获中国抗癌协会科技进步一等奖(第七),入选学校“精英人才库”,3次获得学校“精品教员”称号(全校唯一),荣立“三等功”1次。 Q1 胃癌是最常见的恶性肿瘤之一。在世界范围内,胃癌的发病率居恶性肿瘤第5位。在我国,胃癌似乎来得更凶猛一些。请您谈谈我国胃癌的疾病负担现状和发病情况是怎样的? 在世界范围内,胃癌的发病率居恶性肿瘤第5位。但在我国,胃癌似乎来得更凶猛一些。近5年来,中国年均发生胃癌68.9万例,超过全球年均发病例数的三分之一。死亡例数为年均37.4万例,将近全球总新增死亡例数的一半。根据发病率数据来看,世界范围内,每10万人中,约有11.4位罹患胃癌。我国的胃癌发病率居恶性肿瘤第3位,每10万人中约有21位发病,远高于世界平均水平。 胃癌的早期症状不是很典型,多数胃癌患者确诊时已经是肿瘤晚期。胃癌早期患者5年生存率超过90%,而对于局部晚期与晚期的患者,5年生存率不到20%,所以早期筛查、早期诊断是提高治疗疗效和生存的重要手段。 Q2 胃癌早期的早诊、早治不仅能够挽救患者生命,减轻家庭负担,还可以节约国家医疗资源。请您谈谈,胃癌筛查如何展开?胃癌筛查目标人群有哪些判断标准? (一)胃癌筛查 目前胃癌的诊断和早诊筛查以胃镜和胃镜下活检为主,但是因为胃镜的有创性、检查费用高及需要投入大量的人力资源,所以,人群的接受度较低,使得我国的早诊率不到20%。可以先采用非侵入性方法筛出高风险人群,继而进行有目的的内镜下精查。非侵入性方法指血清胰高血糖素检测和幽门螺杆菌检测。早诊是减少胃癌死亡率,提高生存率的方法,早诊早治、早期发现是非常重要的。胃癌的高危人群应尽早进行胃癌的筛查,早期发现肿瘤后,需要尽早进行治疗。 (二)胃癌筛查目标人群判断标准 首先是年龄的标准,我国40岁以上人群胃癌发生率显著上升。其次,符合以下任意1条,就可以定义为胃癌筛查目标人群。除此之外,为了进一步提升筛选的“精准度”,专家还制定了定量评分的方法——《新型胃癌筛查评分系统》。对不同项目赋予分值,根据分值将筛查目标人群分为3个等级,从而筛选出真正意义上的胃癌高危人群。 根据非侵入性方法的检测结果,通过新型胃癌筛查评分系统评分。对于胃癌高危人群,强烈推荐胃镜精查,每年进行胃镜检查。根据胃镜精查的结果,采用对应的措施。 Q3 胃癌在早期会有什么样的体征和症状呢?具体来看,导致胃癌的因素有哪些?应该如何预防? (一)胃癌早期体征与症状 胃癌早期常无明显症状,随着病情发展,可能会出现饭后上腹部饱胀不适或隐痛,食欲减退、嗳气、反酸、恶心、呕吐、黑便等症状。进展期胃癌可能会表现为体重减轻、贫血、乏力、剧烈腹痛、恶心呕吐、吞咽困难、消化道出血等症状。 (二)致病因素 (1)生活方式,是对我们日常健康影响最大的因素。比如大量食用烧烤、高盐食物和熏制食物,都会促进肿瘤的发展,吸烟、喝酒、肥胖也是胃癌的高风险因素。 (2)感染因素,包括幽门螺杆菌感染(HP)和EB病毒感染。 (3)遗传因素,在胃癌病因学中起到重要的作用。 (4)环境因素,也有很大的影响,长期暴露在粉尘、水泥及其他金属颗粒环境的从业者,胃癌风险显著增加。 (5)慢性萎缩性胃炎、慢性胃溃疡等,是具有胃癌发生风险的癌前疾病,会导致患者的胃癌风险显著升高。种族因素对胃癌发生风险的影响则各不相同。 (三)胃癌预防方法 第一是饮食,饮食尽量以清淡饮食为主,尽量少吃腌制、油炸、霉变食物,多吃新鲜蔬菜水果,保证饮用水清洁,保持健康的生活方式。 第二,不要吸烟,不要喝酒,不要熬夜。 第三,定期检测HP。 第四,定期体检。特别是高危人群,年龄大于40岁,既往有癌症家族史,有胃病,包括萎缩性胃炎、慢性贫血;或曾经做过胃的手术;或有长期进食不良生活习惯的人群;抽烟、喝酒,进食油炸、腌制食物的人,建议每5年做一次胃镜,进行早期筛查。 Q4 非转移性胃癌以手术治疗为主,目前临床探索主要聚焦于术后辅助治疗和术前新辅助治疗。请您谈谈非转移性胃癌的围手术期治疗方案是怎样的? 可手术切除的胃癌应根据临床分期拟定合适的方案。 目前治疗标准是D2手术切除联合术后辅助化疗,对于分期较晚(临床分期Ⅲ期或以上者),可选择围手术期化疗模式。不可手术切除的主要包括肿瘤原因不可切除,存在手术禁忌,或者是患者拒绝,对于个体因素不可接受手术切除的患者,放化疗可作为一种选择,必须充分考虑个体的特殊性后选择最佳治疗策略,配合支持治疗,对症处理等。非转移性胃癌以手术治疗为主,目前临床探索主要聚焦于术后辅助治疗和术前新辅助治疗。 术后辅助治疗方面 中、日、韩三国开展的多项Ⅲ期大型临床研究,奠定了亚洲以辅助化疗作为Ⅱ/Ⅲ期胃癌术后标准治疗的策略。2019年开启了局部进展期胃癌术后SOX(奥沙利铂+S-1)辅助化疗的新时代。回溯探索历程,日本的ACTS-GC研究建议S-1可用于Ⅱ/Ⅲ期胃癌患者术后辅助治疗。基于CLASSIC研究,一项随机、开放、平行对照的Ⅲ期临床研究,XELOX方案(卡培他滨+奥沙利铂)被推荐为胃癌术后辅助化疗的经典方案。JACCRO GC-07研究结果提示S-1联合多西他赛辅助化疗可改善患者的无复发生存期和总生存期。ARTIST 2研究提示在接受D2切除术后淋巴结阳性的Ⅱ/Ⅲ期胃癌患者中,与S-1单药相比,辅助SOX或SOXRT(SOX方案+放疗)可显著延长无病生存期。2019年RESOLVE研究公布,再次肯定了胃癌术后SOX辅助化疗的疗效。 术前新辅助治疗方面 2006年英国MAGIC研究奠定了新辅助化疗+手术+辅助化疗的模式,之后法国的FFCD/FNCLCC研究再次证实围手术期化疗有助于改善患者预后。德国FLOT研究中进行了方案优化,围手术期采用FLOT方案(氟尿嘧啶+亚叶酸钙+奥沙利铂+多西他赛)提高了患者的5年生存率。PRODIGY研究显示DOS方案(多西紫杉醇+奥沙利铂+替吉奥)新辅助化疗联合手术+术后辅助化疗可改善可切除局部进展胃癌的预后。2020年中国的RESOLVE研究SOX逐步成为我国局部进展期胃癌患者围手术期治疗的新经典和新标准。 非转移性胃癌临床治疗的发展主要依赖于围手术期精准临床分期的进步和药物精准治疗研究的深入,靶向和免疫治疗在进展期胃癌新辅助中仍处于探索阶段,尚未成为标准治疗,更多研究数据的结果有待验证与探索,值得未来期待。 二 病例分享 专家简介 卫江鹏 医师 医学博士 空军军医大学西京医院胃肠外科主治医师 01 基本情况 基本信息:男性,43岁,汉族。 现病史:上腹饱胀不适10余天,伴持续性隐痛,无呕血、黑便,无发热、黄疸。 既往史:患糖尿病10余年,规律治疗,血糖控制可。直系亲属无肿瘤病史。 查体:无明显阳性体征。BMI 22.6 kg/m2。 2022-02-08:CT 胃窦壁增厚。强化、僵硬,周围见多发肿大淋巴结、部分融合。肝脏大小形态及各叶比例正常,肝内见多发稍低密度灶、边缘强化,最大径约2.3cm,位于肝左内段。 诊断:1.胃窦癌伴多发肝转移;2.轻度贫血。 肝内转移灶情况 2021-09-02:肿瘤标志物 CEA 9.15 ng/mL(ref.<5.00); CA72-4 5.76 U/mL (ref.<6.90); AFP 28.28 ng/mL (ref.<7.0); CA19-9 2.61 U/mL(ref.<30.00); CA125 13.16 U/mL (ref.<24.00)。 2022-02-10:病理会诊 胃窦低分化腺癌。 免疫组化结果:HER-2(0),MLH1(-),MSH2(+),PMS2(-),MSH6(+),PD-L1(22C3) (CPS=1)。 基因检测:MSI-H。 病例特点: 原发病灶初始可切除伴轻度贫血; 远处转移(肝内多发转移); 局部多发淋巴结转移。 02 临床研究 CheckMate -649 研究 首个且规模最大的晚期胃癌一线免疫治疗III期临床研究。 mOS较化疗延长半年。 纳武利尤单抗+化疗,PFS翻倍。 纳武利尤单抗+化疗,显著提升疾病缓解,ORR近70%。 纳武利尤单抗联合化疗,被国内外权威指南一致推荐用于晚期胃癌一线全人群治疗方案。 03 治疗方案 XELOX + 纳武利尤单抗(Q3W) 04 诊治过程 05 疗效评估 2022-05-05:4周期治疗后CT评估。 1.胃窦部恶性占位,较前(2022-02-08)减轻;2.食管后方、腹腔及腹膜后多发肿大淋巴结,较前减小;3.肝内多发转移,较前明显减小显示不清。 2022-05-05:CT 治疗前后CT对比 06 治疗首阶段小结 治疗效果评价:PR; 仍存在贫血症状; 评估手术治疗,患者拒绝手术治疗; 继续治疗两周期后出现不完全性幽门梗阻症状。 2022-08-10与2022-05-05:CT对比 1.胃窦部恶性占比较前加重,食管后方、腹腔及腹膜后多发肿大淋巴结,部分较前减少; 2.肝内多发转移现显示不清; 3.右肺下叶、左肺上叶小结节同前,多系良性,请随诊。 实验室检查结果监测 肿瘤标志物监测 2022-08-16:完全腹腔镜远端胃癌切除术。 胃窦低分化腺癌ypT3N0,TRG:2级;免疫组化结果:HER-2(0),MLH1(-),MSH2(+),PMS2(-),MSH6(+)。 *本文仅代表专家观点,并经专家审校。