引用本文:洪灿林, 王馨羚, 刘宗超, 李文庆. 基于人群的幽门螺杆菌筛查与治疗策略用于胃癌预防:WHO-IARC 2025年胃癌工作组报告解读[J]. 肿瘤防治研究, 2026, 53(1): 27-35.
基金项目:科技创新2030-“癌症、心脑血管、呼吸和代谢性疾病防治研究”重大项目(2023ZD0501400);国家自然科学基金(82273704)
作者单位:100142 北京,北京大学肿瘤医院暨北京市肿瘤防治研究所流行病学研究室,消化系肿瘤整合防治全国重点实验室
通信作者:李文庆,男,博士,研究员,主要从事肿瘤流行病学与分子流行病学研究,E-mail: wenqing_li@bjmu.edu.cn,ORCID: 0000-0002-8336-5552
作者简介:洪灿林,男,博士在读,主要从事胃癌流行病学研究,ORCID: 0009-0001-4805-2737
通讯作者简介 李文庆 教授 研究员,博士生导师,消化系肿瘤整合防治全国重点实验室PI、北京大学肿瘤医院临床流行病学研究中心副主任。入选国家级高层次青年人才计划、北京市海聚工程、北京市特聘专家、北京市登峰人才团队负责人、北京市优青拔尖个人。哈佛医学院和美国NCI博士后,归国前任常青藤名校布朗大学助理教授。学科方向为肿瘤流行病学,既往工作聚焦胃癌防控策略研究。已发表各类文章/著作超200篇(部),含SCI收录论文156篇,包括BMJ、Nature Medicine、JCO等高水平杂志(H-指数=53),入选斯坦福全球前2%顶尖科学家。曾获中国肿瘤青年科学家奖、NIH-CSSA优秀科学家奖、美国职业基金会学术生涯进展奖等。学术任职包括中国科协全国代表、中国抗癌协会理事及首届青年理事会副理事长、中华预防医学会癌症筛查与早诊专委会副主委、中国抗癌协会癌症筛查与早诊早治专委会常委兼秘书长及肿瘤流行病学专委会常委、中国营养学会营养与组学技术分会副主委。担任WHO—国际癌症研究机构(IARC)等多个国际组织的咨询专家,并作为中国区责任作者撰写IARC胃癌报告指南(2025)。
摘 要:胃癌是全球范围内严重威胁人类生命健康的重大公共卫生问题,根除幽门螺杆菌(H. pylori)感染是开展胃癌一级预防的关键手段。2025年4月,世界卫生组织国际癌症研究机构发布了新版胃癌工作组报告,系统提出了基于人群的H. pylori筛查与治疗策略,全面阐述了从需求与准备情况评估、检测与治疗方案选择、抗生素耐药管理,到质量保障体系构建、健康公平性促进和成本效益优化等核心实施要素,旨在为全球胃癌预防实践提供科学指导。本文对该报告进行了全面梳理与深度解读,并结合我国胃癌防控现状,探讨其对制定与实施符合我国国情、更具成本效益的本土化人群H. pylori筛查与治疗策略的借鉴意义。 关键词:胃癌;幽门螺杆菌;筛查与治疗;世界卫生组织国际癌症研究机构
0 引言
胃癌是全球常见的消化道恶性肿瘤,侵袭性强、转移率高,预后不良,带来沉重的疾病负担,是重大公共卫生问题。2022年全球癌症数据显示,胃癌发病和死亡均位居第五位,新发96.9万例、死亡66.0万例;预计到2050年,新发与死亡将分别增加87.5%和94.7%[1]。胃癌发生发展涉及多因素协同作用,幽门螺杆菌(Helicobacter pylori, H. pylori)感染为其首要的生物学致病因素。研究显示,H. pylori感染在非贲门胃癌中归因风险显著,亚洲和欧洲/北美地区人群归因分值分别约79%和87%[2]。该菌主要作用于胃黏膜病变的早期阶段,通过诱发慢性炎性反应、破坏胃黏膜屏障及干扰细胞信号转导等机制发挥促癌作用,被国际癌症研究机构(International Agency for Research on Cancer, IARC)列为Ⅰ类致癌物[3]。多项前瞻性研究证实,根除H. pylori感染能够降低胃癌发病率和死亡率,且效应随时间累积而增强[4-7]。 基于前期研究证据,IARC胃癌工作组于2014年发布报告,建议各国探索将人群H. pylori筛查与治疗(Screen-and-treat)策略纳入胃癌预防计划,并强调需系统评估实施流程、可行性、效果及潜在风险[8]。中国山东一项18万人整群随机对照研究(Randomized controlled trial, RCT)证实该策略在大规模社区人群中具备有效性和可行性[9]。不丹[10]以及中国马祖列岛[5]等高风险地区开展的项目也显示出显著的预防效果;该策略还获得欧洲抗癌计划(Europe’s Beating Cancer Plan)的认可与支持。然而,全球仍缺乏统一的实施与评估标准,限制了其推广应用。 为进一步降低胃癌疾病负担,2025年4月,WHO-IARC官网(https://publications.iarc.who.int/648)发布新版胃癌工作组报告《Population-Based Helicobacter pylori Screen-and-Treat Strategies for Gastric Cancer Prevention: Guidance on Implementation》,由20个国家/地区的35位专家共同完成[11]。相较于2014年版报告侧重于H. pylori筛查与治疗策略的可行性探索与证据评估,新版报告立足于近十年循证医学证据,从“为何开展”转向“如何规范、高效和公平实施”,明确将H. pylori筛查与治疗作为胃癌一级预防关键措施,为不同地区提供标准化实施方案。其核心亮点在于证据更新和首次提出程序化实施框架,涵盖从前期准备、检测与治疗方案选择、抗生素管理到质量保障、公平促进和成本效益优化的全要素,为全球胃癌一级预防实践迈向体系化、规范化的新阶段提供依据。 本文全面梳理解读该报告提出的H. pylori筛查与治疗策略,结合我国感染现状及胃癌防控目标,探讨国际指南本土化实施路径,为我国构建高效、公平、可持续的胃癌一级预防体系提供参考。 1 基于人群的H. pylori筛查与治疗策略国际共识的形成
基于人群的H. pylori筛查与治疗策略理念始于2005年一次里程碑式的国际工作组会议。该会议系统整合动物实验、细胞生物学、流行病学及临床研究证据,提出根除H. pylori感染具有预防胃癌的潜力[12]。此后多项共识报告和指南陆续发布:2007年《马斯特里赫特Ⅲ共识报告》正式提出“检测与治疗(Test-and-treat)”策略,推荐用于45岁以下出现持续性消化不良的成年患者[13];2008年《亚太地区胃癌预防共识指南》首次明确推荐在胃癌高风险人群开展筛查,反对在低风险人群推行[14];2012年《马斯特里赫特Ⅳ/佛罗伦萨共识报告》建议在低风险地区对有消化道不良症状的年轻患者采用“检测与治疗”策略,并在胃癌疾病负担严重的社区探索实施“筛查与治疗”策略[15];2017年《马斯特里赫特V/佛罗伦萨共识报告》将H. pylori筛查与治疗策略的推荐范围扩展至中低风险社区,并强调如何有效实施基于人群的策略是主要挑战[16];2018年《曼谷共识报告》认为在多数东南亚国家,非侵入性H. pylori筛查与治疗策略比内镜筛查更具可行性与成本效益[17];2020年《台北全球共识报告》明确将13C-尿素呼气试验(Urea breath test, UBT)或粪便抗原检测(Stool antigen test, SAT)列为首选检测方法[18];2021年《中国居民家庭幽门螺杆菌感染的防控和管理专家共识》创新性提出以家庭为单位的防控策略,阻断家庭内传播[19]。 该策略的全球推荐意见建立在不断更新的系统综述和荟萃分析证据基础上。2014年Ford等纳入6项RCT的荟萃分析显示,根除H. pylori可使健康感染者胃癌发生风险下降34%[20];2020年Ford等对证据进行更新,进一步发现根除治疗可使健康个体胃癌发生和死亡风险分别下降46%和39%,并使已患上皮内瘤变或早期胃癌、接受内镜下黏膜切除术患者的后续胃癌发生风险降低51%[21]。但因早期研究规模有限、胃癌事件数少,证据质量仍被普遍认为不足。IARC胃癌工作组近期基于8项RCT共58 628名健康感染者的分析表明,根除治疗可显著降低胃癌发生风险(RR=0.64, 95%CI: 0.48~0.84),预防1例胃癌发生的需治疗数(Number needed to treat, NNT)为228(95%CI: 158~514),见表1;对5项RCT中56 606名健康个体死亡数据的分析显示,根除治疗可降低胃癌死亡风险(RR=0.78, 95%CI: 0.62~0.98),预防1例胃癌死亡的NNT为812(95%CI: 470~8935);针对根除时机与胃癌预防效果关系的争议,工作组还基于3项RCT发现,对已接受内镜下切除术的早期胃癌患者,根除治疗可使复发风险下降48%(RR=0.52, 95%CI: 0.38~0.71),NNT仅为18(95%CI: 14~30),表明在接受根除治疗过程中可能不存在绝对的“不可逆转点”[31]。 除预防胃癌之外,基于人群的H. pylori筛查与治疗策略还可能产生其他系统性健康效应。基于两项RCT的荟萃分析显示,H. pylori根除治疗能有效降低消化不良的发病风险(RR=0.82, 95%CI: 0.74~0.92)。一项基于29项RCT共6 781名患者的系统综述指出,根除H. pylori感染能改善甚至治愈功能性消化不良[32]。另有系统综述整合55项RCT证据表明,根除治疗在预防十二指肠溃疡和胃溃疡复发方面存在显著获益[33]。值得注意的是,既往研究提示H. pylori感染可能与胃食管反流病、糜烂性食管炎、Barrett食管以及食管腺癌风险呈负相关[34],因此存在根除治疗理论上可能增加相关疾病风险的假说。然而,近期Wiklund等的大型队列研究并未观察到根除治疗会增加后续食管腺癌风险[35]。IARC胃癌工作组的荟萃分析同样不支持根除治疗显著改变食管癌的发病风险(RR=1.12, 95%CI: 0.76~1.64)。尽管现有证据未明确支持根除治疗存在显著负面效应,工作组仍建议应继续全面评估其潜在风险,包括抗菌药物耐药性和肠道菌群紊乱等,以促进该策略在人群中的安全推广。 2 基于人群的H. pylori筛查与治疗策略的具体实施框架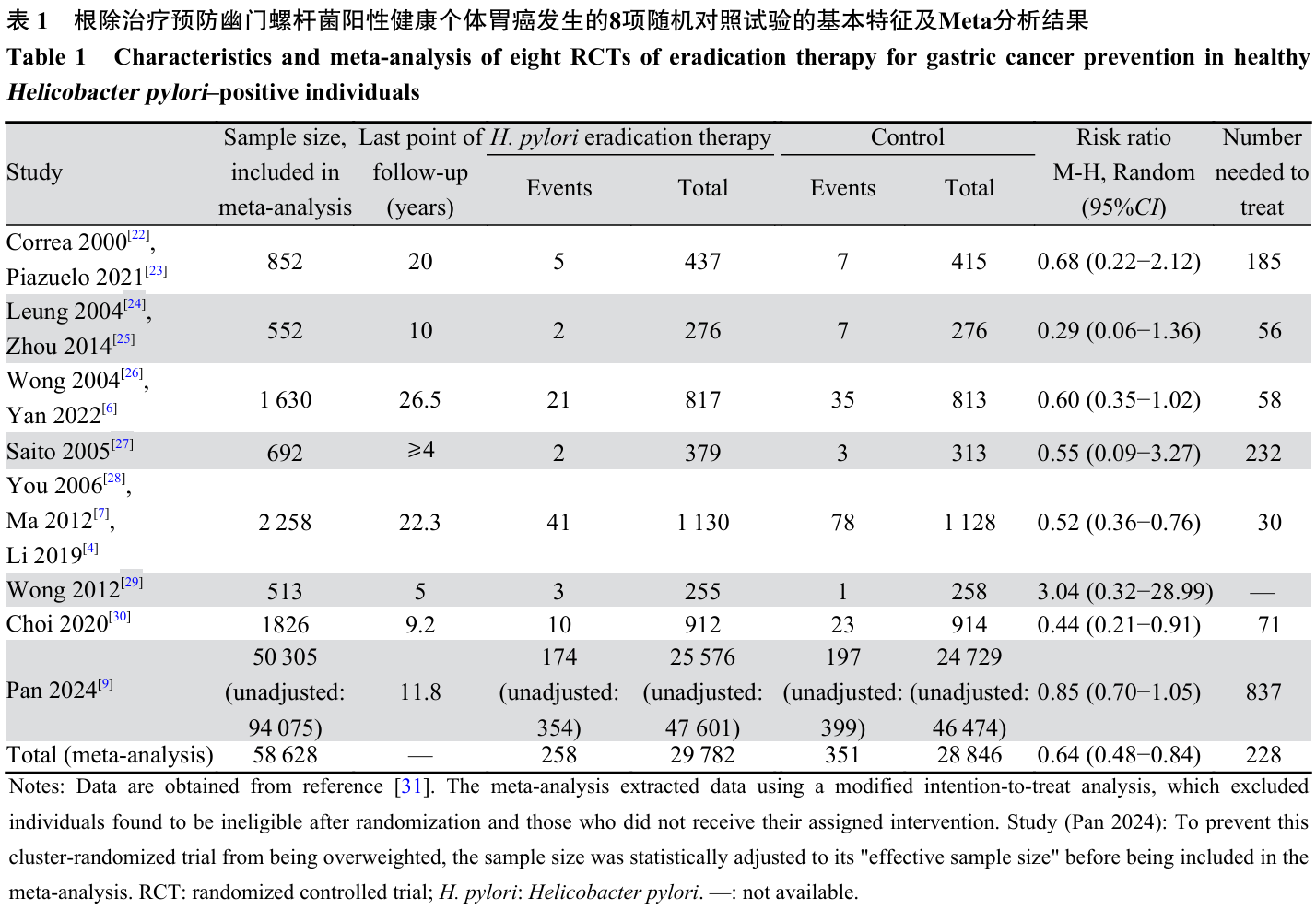
2.1 实施前需求与准备情况评估 IARC胃癌工作组强调,在实施基于人群的H. pylori筛查与治疗策略前,需进行全面需求评估并科学选择目标人群。需求评估应基于近5年的本地数据,重点包括H. pylori感染率、抗生素耐药菌株流行率、H. pylori根除后再感染率、H. pylori相关胃黏膜病变患病率,以及胃癌发病率和死亡率,为精准识别胃癌高发区与高危人群、评估成本效益和权衡利弊提供依据。目标人群的选择应结合流行病学特征、预期成本效益和可用资源条件,主要策略包括:(1)全人群筛查:适用于胃癌中高风险地区,常以特定年龄(如30或40岁)为起点;(2)高危人群筛查:适用于胃癌低风险地区,针对有胃癌家族史、特定人口学特征(如特定族裔或高风险地区移民)等高危群体,以提高成本效益和风险获益比;(3)家庭筛查:针对H. pylori感染者或胃癌患者的家庭成员,以阻断家庭内传播和降低再感染风险。目前筛查与治疗的最佳年龄尚未统一。现有证据支持在年轻成年人群中实施干预的成本效益最高,获益可能随年龄增长而降低[18,36]。 准备情况评估应围绕四个核心方面:(1)是否具备充足的H. pylori检测资源;(2)是否拥有有效、可负担且基于当地耐药数据的根除方案;(3)是否建立完善的运行基础设施;(4)是否制定能够最大化目标人群参与度的有效策略。这些需个人、社区和医疗系统多方协同,项目必须确保拥有可持续的资金与人力资源、标准化工作流程(包括筛查注册、结果反馈和治疗途径),并推荐采用电子信息平台进行追踪与管理。同时,需配备与筛查技术相应的检测设施、场地及人员,建立质量保证体系,提供基于本地指南和耐药谱的医护人员培训,并确保抗H. pylori药物的可及性。为提高参与率,建议为符合条件的参与者提供免费筛查与治疗,并通过多元渠道开展健康教育。全面推行前应进行试点研究,利用筛查参与率、H. pylori阳性率、治疗依从性与有效性等指标评估该策略在真实世界中的可行性与接受度,为后续推广提供资源需求预测、成本效益建模及循证政策制定的实证依据。 2.2 H. pylori检测方法的选择 基于人群的H. pylori筛查应优先选用非侵入性检测方法,主要包括13C-UBT、SAT和血清学检测,见表2。13C-UBT通过检测呼气中13CO2浓度变化反映现症感染,敏感度和特异度通常均高于95%,适用于初次诊断和根除后复查[37];SAT采用单克隆抗体检测粪便样本中的H. pylori特异性抗原,敏感度和特异度可达90%以上,但其结果受抗原表位的保守性、样本处理及时性和储存条件影响[38];血清学检测通过检测H. pylori特异性IgG抗体进行筛查,具有成本低、操作简便的优点,但无法区分现症与既往感染,不适用于评估H. pylori是否成功根除[39]。侵入性检测手段(如快速尿素酶试验、组织学检查和细菌培养)因成本高、操作复杂,一般不用于大规模人群筛查,除非结合内镜胃癌筛查项目同步开展。此外,基于粪便样本的分子检测技术,如聚合酶链式反应(Polymerase chain reaction, PCR),虽受成本与可及性限制尚未广泛应用于人群筛查,但能够同步检测H. pylori感染与抗生素耐药突变,显示出指导个体化治疗的潜力[40]。 检测方法的选择需综合考虑检测性能、可及性及目标人群的感染率等。检测性能主要由敏感度和特异度决定,而在临床实践中,结果解读更依赖于阳性预测值(检测阳性中真实阳性的比例)和阴性预测值(检测阴性中真实阴性的比例),两者均受检测性能和人群感染率的共同影响。实际应用中还需兼顾基础设施条件(如实验室设备和样本运输要求)、受试者偏好(如对粪便或血液样本的接受度)以及包含检测与后续诊疗的综合成本。 基于上述因素,可选用以下两种检测路径:一是一步法,直接使用高精度的13C-UBT或SAT;二是在感染率较低(如< 30%)的地区,采用更具成本效益的两步法,即先用高敏感度血清学检测初筛,阳性者再以13C-UBT或SAT确认。无论采用何种路径,对确诊并接受治疗的个体,应在完成治疗至少4周后使用13C-UBT或SAT复查,以确认H. pylori根除成功,此为保证疗效和控制耐药的关键步骤。在开展H. pylori检测的同时,还需评估受检者的胃癌风险。对高龄、有上消化道癌家族史或出现预警症状(如不明原因缺铁性贫血、可触及腹部包块或淋巴结肿大、消化道出血等)的高危个体,需结合内镜检查胃黏膜状况,以实现胃癌的早期筛查与干预[36]。 2.3 H. pylori治疗方案的选择 一次性成功根除H. pylori感染是预防继发性耐药和避免额外诊疗的关键,是H. pylori治疗方案的核心目标。理想的治疗策略为基于个体化药敏试验(如内镜活检组织培养或粪便样本PCR检测耐药突变)实现精准治疗。然而,受药敏检测的侵入性、成本和可及性限制,大规模筛查项目中经验性治疗仍是主要模式。经验性方案的选择必须依据高质量的本地数据,包括对临床治疗结局和抗生素耐药率的长期动态监测。某一方案在特定地区的根除成功率明显下降,提示可能发生耐药流行,应避免继续将其作为经验性治疗的首选。患者依从性是无症状人群筛查中的另一关键挑战,复杂的给药方案和潜在的不良反应可能降低治疗完成度。因此,宜选择简便易行、耐受性好的方案,并配合充分的医患沟通和健康宣教,以提高治疗成功率。最终方案的选定还需综合考量药物可及性、经济成本、卫生体系支持,乃至对生态环境中菌群耐药性的潜在影响,并参照各国最新的H. pylori临床指南。 目前全球已发展出多种根除方案。标准的克拉霉素三联疗法(质子泵抑制剂[Proton pump inhibitor, PPI]+克拉霉素+阿莫西林/甲硝唑)曾是主流,但由于全球克拉霉素耐药率上升,其根除率已降至70%以下,在克拉霉素耐药菌株感染者中甚至低至18%,仅在耐药率<15%且根除率>90%的少数地区可考虑作为一线选择[36,41]。经典的铋剂四联疗法(PPI+铋剂+四环素+甲硝唑)因成本低、不受克拉霉素耐药影响,且能通过剂量和疗程调整克服甲硝唑耐药,被推荐为高耐药率或耐药情况不明地区的首选一线治疗方案,但其给药方案相对复杂、依从性较差,且铋剂与四环素在部分国家可及性有限[42]。其他备选方案包括非铋剂四联伴同疗法(PPI+克拉霉素+阿莫西林+甲硝唑),虽不受单一克拉霉素或甲硝唑耐药影响,但在双重耐药情况下疗效显著下降;高剂量双联疗法(PPI+阿莫西林)及基于伏诺拉生等钾离子竞争性酸阻滞剂(Potassium-competitive acid blockers, P-CABs)的新型疗法在特定人群中显示出良好潜力,但疗效稳定性需更多研究证实;利福布汀和氟喹诺酮类药物由于潜在的严重不良反应和耐药风险,通常仅用于多重治疗失败后的挽救治疗。 2.4 加强抗生素管理 开展大规模人群的H. pylori筛查与治疗项目时,需权衡胃癌预防的长期获益与抗生素广泛使用所致的耐药风险上升这一核心挑战。尽管H. pylori全球感染率呈下降趋势[43],但对抗生素(尤其是克拉霉素、左氧氟沙星和甲硝唑)的耐药率却在持续上升,东南亚地区克拉霉素耐药率和西太平洋地区左氧氟沙星耐药率分别从2006~2008年的13%和12%增至2012~2016年的21%和31%[44],主要归因于全球抗生素处方的增加。 基于人群的H. pylori筛查与治疗项目将进一步提高抗生素用量,IARC胃癌工作组构建的预测模型显示,多数国家抗生素日规定剂量(Defined daily dose, DDD)将增加1%~3%,中国和哥伦比亚增幅更高(分别为11%和7%),若考虑根除失败后再治疗,实际增幅可能更大。因此,必须建立并实施强有力的抗生素管理策略,组建涵盖胃肠病学、感染病学、临床微生物学、流行病学和临床药学专家的多学科团队,制定详尽的抗生素管理核查清单,并依据“5D原则”不断优化治疗,即准确诊断(Diagnosis)、合理选药(Drug)、适当剂量(Dosing)、优化疗程(Duration)和适时停药(Discontinued)。实施中应依据本地耐药监测数据优先选用高根除率、低耐药风险的方案(如铋剂四联疗法),并严格遵循WHO的AWaRe(Access, Watch, Reserve)分类标准,限制使用耐药风险较高的“Watch”类抗生素,如克拉霉素、左氧氟沙星、环丙沙星、头孢呋辛和利福布汀,以促进抗生素合理使用并延缓耐药发展。 有效的抗生素管理还需依托长期动态的根除率评估和耐药性监测机制。根除效果评估可采用两种方式:一是对所有接受治疗的受检者进行常规的根除后复查,数据准确且能加强医患互动,但成本高、流程复杂,可能因反复治疗失败给部分患者带来心理负担;二是随机抽取代表性亚群检测,更具成本效益且能减少抗菌药物暴露,但需科学设计抽样以保证结果可靠。建立并定期更新本地化耐药谱对指导经验性治疗也至关重要。中国台湾彰化县的实践表明,结合根除后复检与耐药性监测能有效指导抗菌药物使用,控制社区耐药传播[45]。 长远来看,预防性疫苗是根除H. pylori感染并规避抗生素耐药的理想手段,但由于H. pylori免疫逃逸机制复杂,有效的H. pylori疫苗研发仍面临着巨大挑战,尚无成熟产品上市,多数候选疫苗仍处于临床前研究阶段。因此,当前严格遵循强有力的抗生素管理原则,仍是保障人群H. pylori筛查与治疗项目安全可持续实施的关键。 2.5 保障质量与促进公平 保障H. pylori筛查与治疗项目的实施质量需构建基于信息系统的全流程监测评估体系。该体系需在遵循数据保护法规及知情同意原则基础上,整合从招募、检测、治疗到随访的全周期数据,支持标准化高效管理,并为多级质量评价提供依据。质量保障的核心在于持续监测三类指标:短期指标关注运行效率与规范,包括受邀人群覆盖率、筛查参与率、检测阳性率、不合格检测率、阳性者治疗率、抗生素处方率、成功根除率、不良事件发生率及中断治疗率;中期指标反映干预措施的阶段性成效,如筛查覆盖率、H. pylori感染率和成功根除后再感染率;长期指标聚焦胃癌发病率与死亡率的变化,是衡量项目最终效果的关键。此外,需设立质量基准,监测根除H. pylori感染对胃酸环境、胃肠道菌群多样性及抗生素耐药性的潜在影响,以优化治疗方案并控制风险。强化质量指标监测可推动项目持续改进,提升检测准确性、治疗有效性和流程规范性,实现资源高效配置与项目安全运行。 促进公平的核心是确保胃癌高风险人群能平等参与并获益,从而缩小健康差距。胃癌和H. pylori感染负担多集中于社会经济地位较低人群及部分少数族裔,这些群体往往面临获取医疗服务的多重障碍。因此,项目需将公平理念融入顶层设计,采取以受检者为中心的策略,提升招募、检测、治疗及随访环节的可及性。一方面,所有质量评估指标须按社会经济地位、地理位置、族裔、性别等关键特征分层监测,系统比较高风险与普通人群在筛查参与率、阳性者治疗率以及成功根除率等方面的差异,评估策略的可及性、可接受性和可负担性,识别健康不平等现象;另一方面,应采取差异化招募与沟通策略,如使用多语种传播材料,克服信息壁垒,提升高风险人群的参与意愿与治疗依从性。中国台湾地区针对少数民族的项目通过与地方卫生服务者合作、利用远程会诊和多渠道宣传等方式,实现了80%的筛查参与率和91%的成功根除率[46];新西兰重点关注毛利人和太平洋族裔,与毛利卫生服务机构合作设计符合本土文化的筛查与治疗服务,发现对毛利人群实施H. pylori筛查的成本效益远高于其他族裔[47],为促进公平实践提供了重要范例。 2.6 优化成本效益 开展基于人群的H. pylori筛查与治疗项目的成本效益评估,是优化公共卫生资源配置的关键。决策模型作为核心分析工具,通常基于疾病自然史(如Correa模型)构建,采用马尔可夫模型或微观模拟等方法量化疾病进展,并整合地区特定的人口、疾病与结局数据(如H. pylori感染率、胃癌发病率、筛查参与率、检测与治疗成本及负效用估计值等),预测不同策略的效益、风险和资源需求,为政策制定提供依据。在项目全面实施前,开展试点研究以获取精准的本地数据是优化决策的基础。现有研究表明,H. pylori筛查与治疗在全球范围内具有良好的成本效益,即使在低发地区也同样适用[48]。然而,最具成本效益的策略存在地区差异,需因地制宜进行优化。在检测方法方面,尽管既往研究提示SAT可能较血清学检测更具成本效益[49],但目前证据有限,且无单一方法在所有场景中绝对占优,因此最终决策宜依据各地区的资源可及性和实施可行性综合选择。在筛查起始年龄方面,高发地区建议从年轻人群开始以最大化预防效果,低发地区则设定在40~50岁可实现更优的成本效益平衡。当前H. pylori筛查频率的卫生经济学证据较为有限,但既往研究表明重复筛查的额外获益不足以抵消其增加的资源消耗[50],因此建议优先考虑一次性筛查与治疗策略。 为进一步提升H. pylori筛查与治疗项目的效率与参与度,可结合现有其他筛查手段协同推进。例如,联合H. pylori血清学与胃蛋白酶原检测可更精确地识别胃黏膜萎缩的高风险个体;结直肠癌筛查中可同步采用粪便免疫化学检测(Faecal immunochemical test, FIT)的样本进行SAT检测,提升参与率并协同预防消化道肿瘤。此外,将根除治疗与健康饮食、戒烟等行为干预结合,可产生更广泛的健康效益。成本效益评估还需全面考量其附加效应,包括预防消化性溃疡、胃淋巴瘤和消化不良等正向收益,以及可能加剧细菌耐药等风险。当前,将理论成本效益转化为实际公共卫生获益仍面临关键证据缺口,包括抗生素耐药与健康公平性的量化不足、最优实施方案的细节尚未明确、缺乏全面的资源需求评估。未来需通过高质量试点项目监测填补空白,持续更新决策模型,优化策略成本效益,为全球不同地区的政策制定者提供可靠依据。 3 中国H. pylori筛查与治疗的实践与展望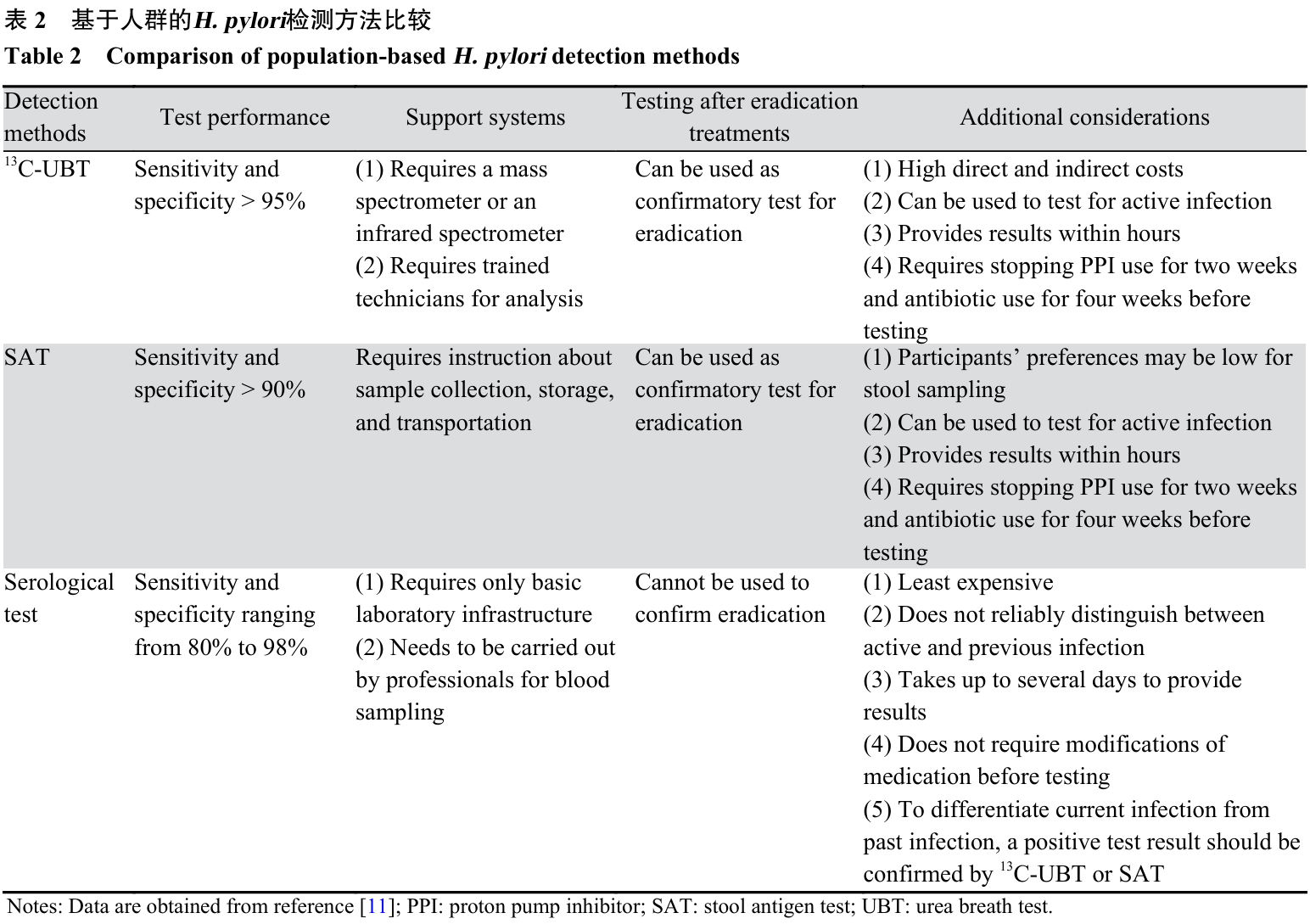
中国是胃癌高发国家,2022年新发病例35.87万例(粗发病率25.41/10万),死亡26.04万例(粗死亡率18.44/10万),发病和死亡顺位分别居第5和第3位[51]。1990—2021年我国胃癌的年龄标化发病率和死亡率显著下降[52]。但因起病隐匿、早期症状不明显,多数患者确诊时已属中晚期,5年生存率仅35.2%[53]。H. pylori感染是胃癌的关键致病因素,中国慢性病前瞻性研究(China Kadoorie Biobank, CKB)显示,78.5%的非贲门胃癌病例和62.1%的贲门胃癌病例可归因于H. pylori感染[54]。目前我国H. pylori感染率约为40.7%~49.4%[19,55-56],存在明显地域差异,西北(51.8%)、东部(47.7%)和西南(46.6%)地区感染率显著高于其他地区[56]。家庭聚集性是另一重要特征,父母均阳性的家庭子女感染率高达34.3%,远高于父母均未感染的家庭(13.6%)[55]。家庭规模大、多代同住、居住拥挤及卫生条件差是导致家庭内传播的主要危险因素。 自20世纪90年代以来,我国在胃癌高发区开展多项RCT验证H. pylori根除对胃癌的一级预防效果。山东干预试验(Shandong intervention trial, SIT)对3 365名受试者随访14.7年,发现根除H. pylori感染可显著降低胃癌的发生风险(OR=0.61, 95%CI: 0.38~0.96),首次通过单中心RCT明确根除治疗可降低胃癌发病率[7];延长随访至22.3年,进一步证实根除治疗可持续降低胃癌的发生(OR=0.48, 95%CI: 0.32~0.71)和死亡风险(HR=0.62, 95%CI: 0.39~0.99)[4]。福建长乐地区基于1 630名H. pylori感染者的RCT经26.5年随访显示,根除组胃癌发病率较安慰剂组降低43%(HR=0.57, 95%CI: 0.33~0.98)[6]。山东烟台地区587名感染者的RCT发现根除治疗可延缓肠化生进展(OR=0.63, 95%CI: 0.43~0.93)[24]。在既往研究基础上,为深入探索根除H. pylori感染预防胃癌策略在大规模人群中应用的可行性,山东临朐县大规模干预试验(Mass intervention trial in linqu, Shandong province, MITS)纳入约18万名受试者,经11.8年随访发现根除治疗组胃癌发病率显著降低19%(HR=0.81, 95%CI: 0.69~0.96),分层分析显示成功根除可使25~45岁人群胃癌发病率和死亡率分别降低35%(HR=0.65, 95%CI: 0.46~0.93)和43%(HR=0.57, 95%CI: 0.33~0.98),为高风险社区从成年早期开展大规模筛查与治疗以预防胃癌提供了关键证据[9]。既往卫生经济学研究进一步证实,该策略能够有效降低胃癌发病率并节省医疗成本,对高风险及普通无症状人群均具有成本效益[57]。 在政策与临床指导层面,我国已相继出台相关共识指南。2021年《中国居民家庭幽门螺杆菌感染的防控和管理专家共识》提出以家庭为单位的防控策略,通过对感染的家庭成员进行筛查、治疗和随访,阻断家庭内传播,提高家庭成员的共同防范意识,从而更有效地降低胃癌发生风险并节省医疗开支[19]。2023年《中国幽门螺杆菌感染防控》白皮书系统提出国家层面的人群干预方针,优先在胃癌高发区人群开展干预并逐步推广,建议高发区实施“筛查—治疗”策略,非高发区采用“检测—治疗”策略[58]。 然而,当前我国推行该策略仍面临着诸多挑战。一方面,根除治疗的远期系统性影响尚未完全明确,其对胃食管反流病、胃肠道微生态等复杂效应有待深入研究;另一方面,抗生素耐药问题日益严峻。一项全国多中心监测研究显示,我国城市人群对克拉霉素和左氧氟沙星的平均耐药率分别达50.83%和47.17%,严重制约经验性治疗的疗效和根除率[59]。为应对挑战并优化策略,未来应推进精准胃癌一级预防,整合H. pylori感染、遗传易感性及生活方式等信息构建风险预测模型,使资源靶向最高危人群,同时加强抗生素管理,建立全国耐药动态监测网络,推广基于药敏试验的个体化治疗方案,并探索新方案以应对耐药菌株。此外,鉴于H. pylori感染的家庭聚集性,推广以家庭为单位的综合防控模式对切断传播链也至关重要。
4 结论
2025年IARC胃癌工作组报告为在全球范围内推广基于人群的H. pylori筛查与治疗策略以预防胃癌提供了首个系统性的实施框架和循证指导,具有里程碑式意义。该报告基于最新证据,进一步确认了根除H. pylori感染对降低胃癌发病与死亡风险的显著作用,并系统阐述了从需求与准备情况评估、检测与治疗方案选择、抗生素管理,到质量保障、健康公平促进及成本效益优化等全流程实施要点。我国胃癌疾病负担沉重、H. pylori感染率高,该报告为国家层面制定和优化防控策略提供了重要的国际经验与科学依据,对本土化实践具有重大借鉴价值。未来,我国应在IARC报告普适性原则的基础上,结合国情积极推动H. pylori筛查与治疗项目的开展,优化配置卫生资源,最大化胃癌预防效果,助力“健康中国”战略目标的实现。
参考文献 [1] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263. [2] Gu J, He F, Clifford GM, et al. A systematic review and metaanalysis on the relative and attributable risk of Helicobacter pylori infection and cardia and non-cardia gastric cancer[J]. Expert Rev Mol Diagn, 2023, 23(12): 1251-1261.x [3] Goldenring JR, Mills JC. Cellular Plasticity, Reprogramming, and Regeneration: Metaplasia in the Stomach and Beyond[J]. Gastroenterology, 2022, 162(2): 415-430. [4] Li WQ, Zhang JY, Ma JL, et al. Effects of Helicobacter pylori treatment and vitamin and garlic supplementation on gastric cancer incidence and mortality: follow-up of a randomized intervention trial[J]. BMJ, 2019, 366: l5016. [5] Chiang TH, Chang WJ, Chen SL, et al. Mass eradication of Helicobacter pylori to reduce gastric cancer incidence and mortality: a long-term cohort study on Matsu Islands[J]. Gut, 2021, 70(2): 243-250. [6] Yan L, Chen Y, Chen F, et al. Effect of Helicobacter pylori Eradication on Gastric Cancer Prevention: Updated Report From a Randomized Controlled Trial With 26.5 Years of Follow-up[J]. Gastroenterology, 2022, 163(1): 154-162. e3. [7] Ma JL, Zhang L, Brown LM, et al. Fifteen-year effects of Helicobacter pylori, garlic, and vitamin treatments on gastric cancer incidence and mortality[J]. J Natl Cancer Inst, 2012, 104(6): 488-492. [8] IARC Helicobacter pylori Working Group. Helicobacter pylori Eradication as a Strategy for Preventing Gastric Cancer (IARC Working Group Reports, No. 8)[M]. Lyon: International Agency for Research on Cancer, 2014. [9] Pan KF, Li WQ, Zhang L, et al. Gastric cancer prevention by community eradication of Helicobacter pylori: a cluster-randomized controlled trial[J]. Nat Med, 2024, 30(11): 3250-3260. [10] Dorji T, Wangmo S, Dargay S, et al. Population-level cancer screening and cancer care in Bhutan, 2020–2023: a review[J]. Lancet Reg Health Southeast Asia, 2024, 24: 100370. [11] Park JY. Population-based Helicobacter pylori screen-and-treat strategies for gastric cancer prevention: guidance on implementation (IARC Working Group Reports No. 12)[M]. Lyon: International Agency for Research on Cancer, 2025. [12] Malfertheiner P, Sipponen P, Naumann M, et al. Helicobacter pylori eradication has the potential to prevent gastric cancer: a state-of-the-art critique[J]. Am J Gastroenterol, 2005, 100(9): 2100-2115. [13] Malfertheiner P, Megraud F, O'Morain C, et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht Ⅲ Consensus Report[J]. Gut, 2007, 56(6): 772-781. [14] Fock KM, Talley N, Moayyedi P, et al. Asia-Pacific consensus guidelines on gastric cancer prevention[J]. J Gastroenterol Hepatol, 2008, 23(3): 351-365. [15] Malfertheiner P, Megraud F, O'Morain CA, et al. Management of Helicobacter pylori infection-the Maastricht Ⅳ/Florence Consensus Report[J]. Gut, 2012, 61(5): 646-664. [16] Malfertheiner P, Megraud F, O'Morain CA, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report[J]. Gut, 2017, 66(1): 6-30. [17] Mahachai V, Vilaichone RK, Pittayanon R, et al. Helicobacter pylori management in ASEAN: The Bangkok consensus report[J]. J Gastroenterol Hepatol, 2018, 33(1): 37-56. [18] Liou JM, Malfertheiner P, Lee YC, et al. Screening and eradication of Helicobacter pylori for gastric cancer prevention: the Taipei global consensus[J]. Gut, 2020, 69(12): 2093-2112. [19] Ding SZ, Du YQ, Lu H, et al. Chinese Consensus Report on Family-Based Helicobacter pylori Infection Control and Management (2021 Edition)[J]. Gut, 2022, 71(2): 238-253. [20] Ford AC, Forman D, Hunt RH, et al. Helicobacter pylori eradication therapy to prevent gastric cancer in healthy asymptomatic infected individuals: systematic review and meta-analysis of randomised controlled trials[J]. BMJ, 2014, 348: g3174. [21] Ford AC, Yuan Y, Moayyedi P. Helicobacter pylori eradication therapy to prevent gastric cancer: systematic review and metaanalysis[J]. Gut, 2020, 69(12): 2113-2121. [22] Correa P, Fontham ET, Bravo JC, et al. Chemoprevention of gastric dysplasia: randomized trial of antioxidant supplements and anti-Helicobacter pylori therapy[J]. J Natl Cancer Inst, 2000, 92(23): 1881-1888. [23] Piazuelo MB, Bravo LE, Mera RM, et al. The Colombian Chemoprevention Trial: 20-Year Follow-Up of a Cohort of Patients With Gastric Precancerous Lesions[J]. Gastroenterology, 2021, 160(4): 1106-1117. e3. [24] Leung WK, Lin SR, Ching JY, et al. Factors predicting progression of gastric intestinal metaplasia: results of a randomised trial on Helicobacter pylori eradication[J]. Gut, 2004, 53(9): 1244-1249. [25] Zhou L, Lin S, Ding S, et al. Relationship of Helicobacter pylori eradication with gastric cancer and gastric mucosal histological changes: a 10-year follow-up study[J]. Chin Med J (Engl), 2014, 127(8): 1454-1458. [26] Wong BC, Lam SK, Wong WM, et al. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial[J]. JAMA, 2004, 291(2): 187-194. [27] Saito D, Boku N, Fujioka T, et al. Impact of H. pylori eradication on gastric cancer prevention: endoscopic results of the Japanese intervention trial (JITHP-study): a randomized multi-center trial[J]. Gastroenterology, 2005, 128(Suppl 2): A4. [28] You WC, Brown LM, Zhang L, et al. Randomized double-blind factorial trial of three treatments to reduce the prevalence of precancerous gastric lesions[J]. J Natl Cancer Inst, 2006, 98(14): 974-983. [29] Wong BC, Zhang L, Ma JL, et al. Effects of selective COX-2 inhibitor and Helicobacter pylori eradication on precancerous gastric lesions[J]. Gut, 2012, 61(6): 812-818. [30] Choi IJ, Kim CG, Lee JY, et al. Family History of Gastric Cancer and Helicobacter pylori Treatment[J]. N Engl J Med, 2020, 382(5): 427-436. [31] Ford AC, Yuan Y, Park JY, et al. Eradication Therapy to Prevent Gastric Cancer in Helicobacter pylori-Positive Individuals: Systematic Review and Meta-Analysis of Randomized Controlled Trials and Observational Studies[J]. Gastroenterology, 2025, 169(2): 261-276. [32] Ford AC, Tsipotis E, Yuan Y, et al. Efficacy of Helicobacter pylori eradication therapy for functional dyspepsia: updated systematic review and meta-analysis[J]. Gut, 2022, 71(10): 1967-1975. [33] Ford AC, Gurusamy KS, Delaney B, et al. Eradication therapy for peptic ulcer disease in Helicobacter pylori-positive people[J]. Cochrane Database Syst Rev, 2016, 4(4): CD003840. [34] Zamani M, Alizadeh-Tabari S, Hasanpour AH, et al. Systematic review with meta-analysis: association of Helicobacter pylori infection with gastro-oesophageal reflux and its complications[J]. Aliment Pharmacol Ther, 2021, 54(8): 988-998. [35] Wiklund AK, Santoni G, Yan J, et al. Risk of Esophageal Adenocarcinoma After Helicobacter pylori Eradication Treatment in a Population-Based Multinational Cohort Study[J]. Gastroenterology, 2024, 167(3): 485-492. e3. [36] Malfertheiner P, Megraud F, Rokkas T, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report[J]. Gut, 2022, 71(9): 1724-1762. [37] Best LM, Takwoingi Y, Siddique S, et al. Non-invasive diagnostic tests for Helicobacter pylori infection[J]. Cochrane Database Syst Rev, 2018, 3(3): CD012080. [38] Calvet X, Lario S, Ramírez-Lázaro MJ, et al. Accuracy of monoclonal stool tests for determining cure of Helicobacter pylori infection after treatment[J]. Helicobacter, 2010, 15(3): 201-205. [39] Kawai S, Arai K, Lin Y, et al. Comparison of the detection of Helicobacter pylori infection by commercially available serological testing kits and the (13)C-urea breath test[J]. J Infect Chemother, 2019, 25(10): 769-773. [40] Liu Q, Qi D, Kang J, et al. Efficacy of real-time PCR-based detection of Helicobacter pylori infection and genotypic resistance-guided quadruple therapy as the first-line treatment for functional dyspepsia with Helicobacter pylori infection[J]. Eur J Gastroenterol Hepatol, 2015, 27(3): 221-225. [41] Bujanda L, Nyssen OP, Ramos J, et al. Effectiveness of Helicobacter pylori Treatments According to Antibiotic Resistance[J]. Am J Gastroenterol, 2024, 119(4): 646-654. [42] Mégraud F. The challenge of Helicobacter pylori resistance to antibiotics: the comeback of bismuth-based quadruple therapy[J]. Therap Adv Gastroenterol, 2012, 5(2): 103-109. [43] Chen YC, Malfertheiner P, Yu HT, et al. Global Prevalence of Helicobacter pylori Infection and Incidence of Gastric Cancer Between 1980 and 2022[J]. Gastroenterology, 2024, 166(4): 605-619. [44] Savoldi A, Carrara E, Graham DY, et al. Prevalence of Antibiotic Resistance in Helicobacter pylori: A Systematic Review and Meta-analysis in World Health Organization Regions[J]. Gastroenterology, 2018, 155(5): 1372-1382. e17. [45] Lee YC, Chiang TH, Chiu HM, et al. Screening for Helicobacter pylori to Prevent Gastric Cancer: A Pragmatic Randomized Clinical Trial[J]. JAMA, 2024, 332(19): 1642-1651. [46] Lei WY, Lee JY, Chuang SL, et al. Eradicating Helicobacter pylori via (13)C-urea breath screening to prevent gastric cancer in indigenous communities: a population-based study and development of a family index-case method[J]. Gut, 2023, 72(12): 2231-2240. [47] Teng AM, Kvizhinadze G, Nair N, et al. A screening program to test and treat for Helicobacter pylori infection: Cost-utility analysis by age, sex and ethnicity[J]. BMC Infect Dis, 2017, 17(1): 156. [48] Lansdorp-Vogelaar I, Meester RGS, Laszkowska M, et al. Costeffectiveness of prevention and early detection of gastric cancer in Western countries[J]. Best Pract Res Clin Gastroenterol, 2021, 50-51: 101735. [49] Yousefi M, Rezaei S, Khoshbaten M, et al. Cost-effectiveness analysis of different screening strategies for Helicobacter pylori infection in Iran: A model-based evaluation[J]. Helicobacter, 2023, 28(6): e13027. [50] Yeh JM, Kuntz KM, Ezzati M, et al. Exploring the costeffectiveness of Helicobacter pylori screening to prevent gastric cancer in China in anticipation of clinical trial results[J]. Int J Cancer, 2009, 124(1): 157-166. [51] Han B, Zheng R, Zeng H, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53. [52] Zhang T, Zhang Y, Leng X. Global, regional, and national trends in gastric cancer burden: 1990-2021 and projections to 2040[J]. Front Oncol, 2024, 14: 1468488. [53] Zeng H, Zheng R, Sun K, et al. Cancer survival statistics in China 2019-2021: a multicenter, population-based study[J]. J Natl Cancer Cent, 2024, 4(3): 203-213. [54] Yang L, Kartsonaki C, Yao P, et al. The relative and attributable risks of cardia and non-cardia gastric cancer associated with Helicobacter pylori infection in China: a case-cohort study[J]. Lancet Public Health, 2021, 6(12): e888-e896. [55] Zhou XZ, Lyu NH, Zhu HY, et al. Large-scale, national, familybased epidemiological study on Helicobacter pylori infection in China: the time to change practice for related disease prevention[J]. Gut, 2023, 72(5): 855-869. [56] Ren S, Cai P, Liu Y, et al. Prevalence of Helicobacter pylori infection in China: A systematic review and meta-analysis[J]. J Gastroenterol Hepatol, 2022, 37(3): 464-470. [57] Chen Q, Liang X, Long X, et al. Cost-effectiveness analysis of screen-and-treat strategy in asymptomatic Chinese for preventing Helicobacter pylori-associated diseases[J]. Helicobacter, 2019, 24(2): e12563. [58] 中国疾病预防控制中心传染病预防控制所. 国内首部《中国 幽门螺杆菌感染防控》白皮书正式在京发布[EB/OL]. (2023-06-03)[2025-07-30]. https://icdc.chinacdc.cn/zxxx/gzdt/202306/t20230603_266504.html. [Institute of Infectious Disease Control and Prevention, Chinese Center for Disease Control and Prevention. China's first white paper on the prevention and control of Helicobacter pylori infection was officially released in Beijing[EB/OL]. (2023-06-03)[2025-07-30]. https://icdc.chinacdc.cn/zxxx/gzdt/202306/t20230603_266504.html.] [59] Wang L, Li Z, Tay CY, et al. Multicentre, cross-sectional surveillance of Helicobacter pylori prevalence and antibiotic resistance to clarithromycin and levofloxacin in urban China using the string test coupled with quantitative PCR[J]. Lancet Microbe, 2024, 5(6): e512-e513.
来源:《肿瘤防治研究》