2025年4月3日,中山大学附属第一医院匡铭教授团队牵头的研究在肝细胞癌免疫微环境研究领域取得重要进展,研究成果在线发表于Cancer Cell,题为“Spatial transcriptomics reveals tryptophan metabolism restricting maturation of intratumoral tertiary lymphoid structures”。该研究利用高分辨率时空组学技术描绘了肝细胞癌(HCC)中三级淋巴结构(TLS)的全景发育图谱,首次提出不成熟TLS的全新分子亚型,并揭示不同亚型在调控抗肿瘤免疫及免疫治疗反应中的独特特征。研究也阐明了色氨酸代谢在TLS成熟过程中的关键调控作用,为HCC治疗反应预测和新型免疫联合治疗方案的开发提供了新思路。

中山大学附属第一医院肝胆胰外科中心匡铭教授是该文的最后通讯作者,中山大学中山医学院唐忠辉教授、中山一院精准医学研究院彭穗教授和华大生命科学研究院刘石平教授为该文的共同通讯作者。中山大学中山医学院唐忠辉教授、袁雨辰博士后,中山大学附属第一医院在读博士生曾千文和陈淑玲副主任医师为该文的共同第一作者。
TLS是非淋巴组织(包括肿瘤)在免疫刺激下形成的异位淋巴聚集体。根据生发中心结构的有无,TLS分为成熟和不成熟两种状态。研究表明,成熟TLS及B细胞浸润的存在与包括HCC在内的多种癌症患者生存期延长及免疫治疗应答增强呈正相关。因此,TLS可作为预测免疫治疗疗效的生物标志物,然而目前仅少数患者受益于免疫治疗。
成熟TLS通过增强抗原呈递、细胞因子介导的信号传导及释放肿瘤特异性抗体,发挥内源性抗肿瘤免疫调控作用。而TLS丰度因癌症类型和患者个体差异而显著不同,反映了其动态发育过程及对局部微环境信号的响应。这种异质性可能调控整体抗肿瘤免疫应答及临床结局,但受限于缺乏标准化分类体系,TLS成熟状态的精准判定仍具挑战性。此外,驱动肿瘤内TLS成熟的分子机制及促其发育以优化瘤内免疫应答的策略尚未完全阐明。
为此,研究团队整合29例HCC患者的46份样本数据,基于一套集成自动化鉴定流程,结合病理图像信息、TLS相关基因特征、基因空间共表达模式及免疫细胞簇的空间聚类方法,原位鉴定出937个TLS,并精细区分其内部的31种细胞亚群。
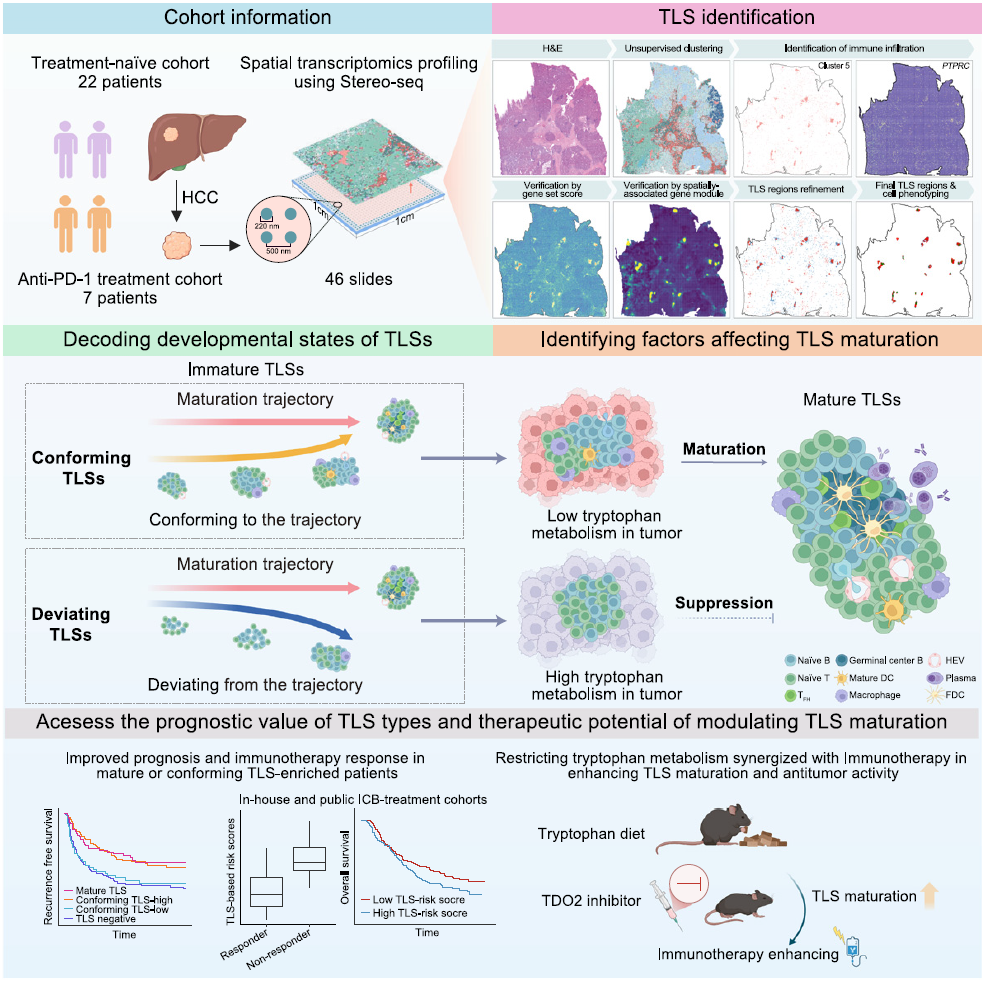
研究示意图
研究发现,TLS在基因表达模式和免疫细胞空间分布上存在显著异质性。基于发育轨迹分析,团队首次将不成熟TLS细分为两类:趋向成熟型TLS(具有潜在发育成熟倾向),具有与成熟TLS相似的抗肿瘤免疫特征,且其抗肿瘤效应在免疫治疗后增强;偏离成熟型TLS(缺乏发育成熟倾向),不具备上述特征及变化。
团队进一步利用机器学习技术在bulk转录组测序数据中对不成熟TLS亚型实现精准分型,发现瘤内存在成熟TLS或富集趋向成熟型TLS均与HCC患者预后改善及ICB疗效提高密切相关。进一步研究发现,偏离成熟型TLS内的B细胞及分布在偏离成熟型TLS周围的肿瘤细胞均具有色氨酸代谢活跃的表型,且以色氨酸代谢关键限速酶TDO2的上调最为显著。
体内外实验证实,高色氨酸代谢的肿瘤细胞通过限制B/T细胞的增殖、激活及分化来抑制TLS成熟;而靶向肿瘤色氨酸代谢可促进TLS成熟并抑制肿瘤进展及提高抗PD-1疗效。