2026年1月9日,天津医科大学肿瘤医院郝继辉教授团队在Gut杂志在线发表了题为“KRAS mutation-driven O-GlcNAcylation of CLDN18.2 enhances the progression of pancreatic cancer and reduces the efficacy of CLDN18.2-targeted therapy”的原创性研究成果。该研究揭示了KRAS突变胰腺导管腺癌(PDAC)中CLDN18.2靶向治疗疗效受限的关键机制,并创新性地提出、验证了低剂量KRAS抑制剂可协同增强CLDN18.2靶向治疗的疗效,为KRAS突变PDAC提供了全新的联合治疗策略。
研究背景
胰腺导管腺癌(PDAC)是预后极差的恶性肿瘤,治疗手段有限。CLDN18.2作为一种肿瘤特异性高表达且定位于细胞膜的紧密连接蛋白,已成为胃癌和胃食管结合部癌备受瞩目的药物靶点。然而,尽管针对CLDN18.2的治疗在胃癌中展现了显著疗效,其在PDAC中的临床获益却相对有限,这提示胰腺癌中可能存在某种调控机制削弱了其疗效。
KRAS突变是PDAC最主要的分子特征之一,其在PDAC中的突变率远高于胃癌和食管癌。既往研究表明,KRAS突变可促进癌细胞葡萄糖摄取,进而激活己糖胺生物合成途径(HBP),导致细胞内UDP-GlcNAc水平升高,从而增加蛋白质的O-GlcNAc糖基化修饰。这种翻译后修饰对于控制蛋白质的活性和定位至关重要。
本研究围绕一个核心临床问题展开:在PDAC中,CLDN18.2的疗效为何不及其他消化道肿瘤?其表达与预后的相关性为何存在争议?研究团队推测,KRAS突变可能通过O-GlcNAc糖基化调控CLDN18.2的的亚细胞定位,进而影响PDAC进展和治疗敏感性。
研究内容
胞质CLDN18.2与PDAC侵袭性相关,而膜CLDN18.2预测靶向治疗敏感性
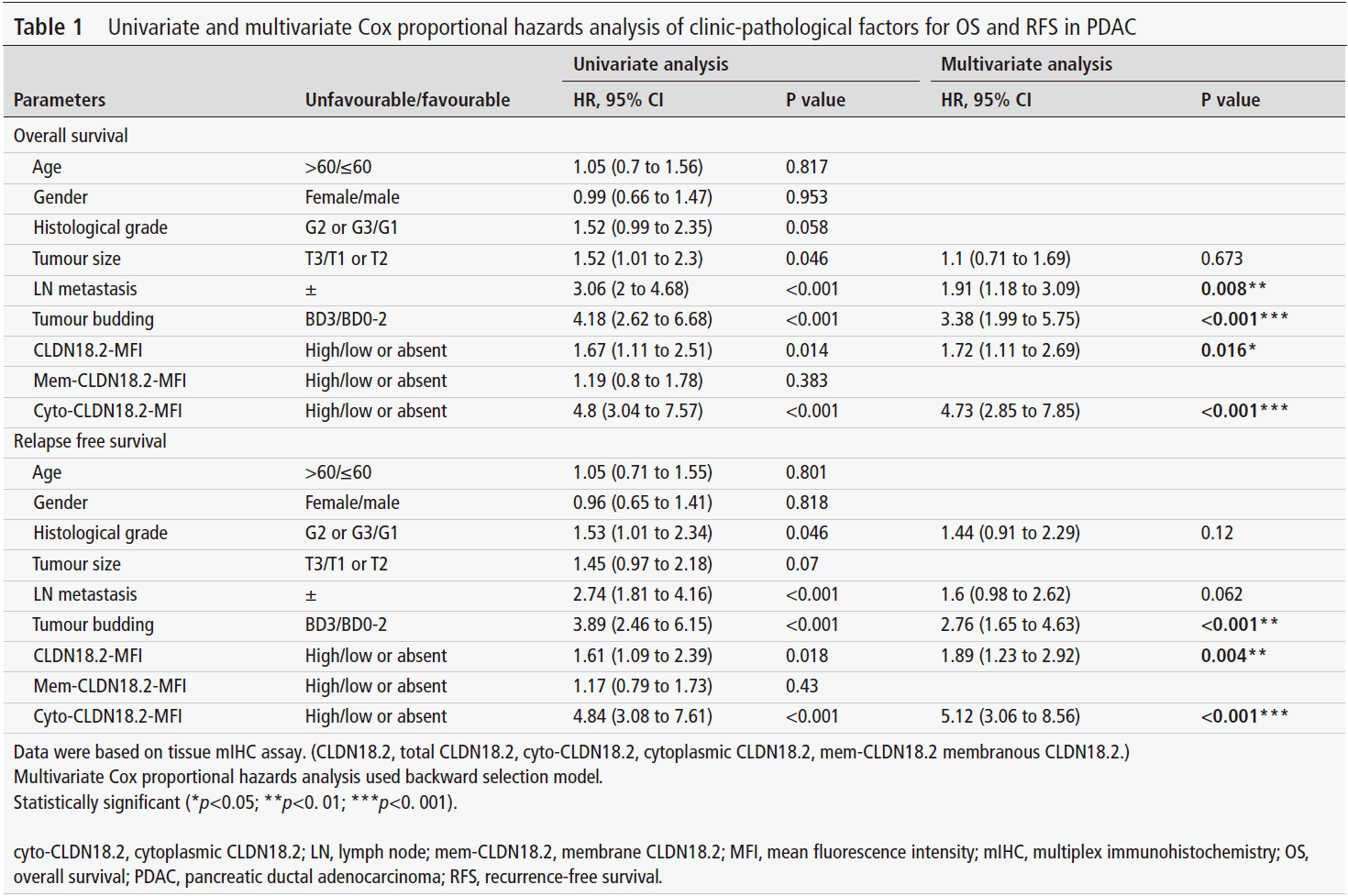
研究团队首先通过免疫组化(IHC)分析了106例PDAC患者的肿瘤样本。结果显示,CLDN18.2在肿瘤组织中的表达强于癌旁正常组织,且存在两种截然不同的定位模式:膜定位(mem-CLDN18.2)和胞质定位(cyto-CLDN18.2)。值得注意的是,66.04%的病例存在胞质表达。
生存分析显示,胞质CLDN18.2是总生存期(OS)和无复发生存期(RFS)的独立负面预后因子,而膜CLDN18.2则没有显示出显著的预后价值。多重免疫组化(mIHC)进一步量化证实,高水平的胞质CLDN18.2与更具侵袭性的临床病理特征相关,包括更大的肿瘤体积、淋巴结转移、肿瘤出芽增加以及循环肿瘤细胞(CTC)计数升高。
表1:基于CLDN18.2亚细胞定位的PDAC患者预后多因素分析
此外,研究者建立了人源化患者来源异种移植(PDX)模型,分为膜优势型和胞质优势型。结果显示:CLDN18.2靶向治疗在膜优势型模型中实现了66.33%的肿瘤生长抑制,而在胞质优势型模型中仅为22.99%。这表明,将胞质CLDN18.2重新定位到细胞膜上,可能是提高胰腺癌靶向治疗疗效的关键。
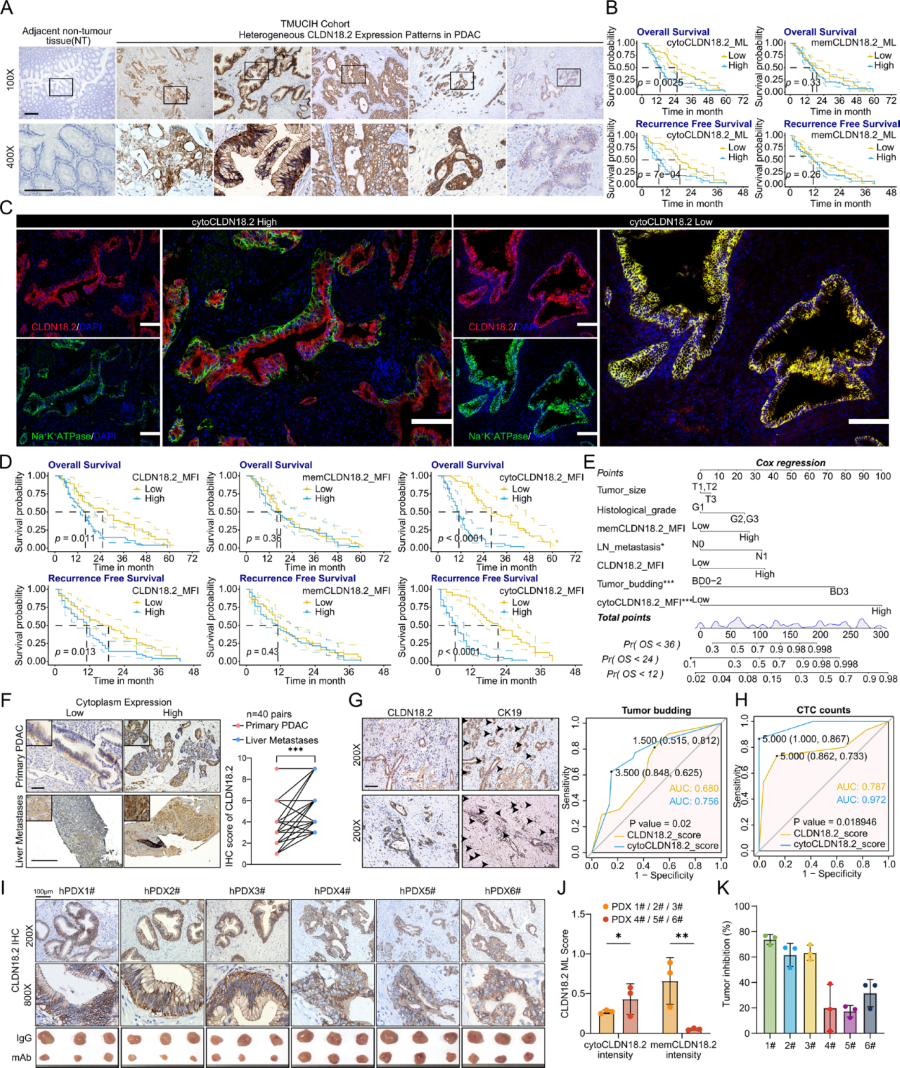
图1:胞质CLDN18.2与侵袭性疾病相关,而膜CLDN18.2可预测PDAC对CLDN18.2靶向治疗的敏感性增强
KRAS突变与高血糖通过O-GlcNAc糖基化促进CLDN18.2胞质分布
为探究CLDN18.2定位改变的机制,研究团队对具有中高表达CLDN18.2的PDAC组织进行了代谢组学和转录组学分析。结果发现,胞质优势型病例中HBP通路代谢物和蛋白质O-连接糖基化基因显著富集。
在KRAS G12D突变的患者来源类器官(PDO)模型中,高血糖环境显著增加了胞质CLDN18.2水平,同时降低了膜CLDN18.2水平。这种葡萄糖依赖性的CLDN18.2重分布在KRAS突变型肿瘤中尤为明显,而在KRAS野生型肿瘤中未观察到。这表明KRAS突变和高血糖协同驱动了这一过程。
机制上,KRAS突变增强了癌细胞的葡萄糖摄取,激活HBP途径,提高了胞内UDP-GlcNAc水平,进而促进CLDN18.2发生O-GlcNAc糖基化。O-GlcNAc糖基化修饰破坏了CLDN18.2与细胞膜支架蛋白ZO1的相互作用。抑制O-GlcNAc转移酶(OGT)可增强CLDN18.2-ZO1结合并促进CLDN18.2膜定位,而增强O-GlcNAc糖基化则产生相反效果。在PDO模型中,表达KRAS G12D或使用高糖处理均能增加CLDN18.2的O-GlcNAc糖基化,减少其与ZO1的结合;而使用KRAS抑制剂MRTX1133或OGT抑制剂OSMI-1则可逆转这一过程。体内实验也证实,MRTX1133治疗可减少肿瘤中胞质CLDN18.2,增加膜CLDN18.2。
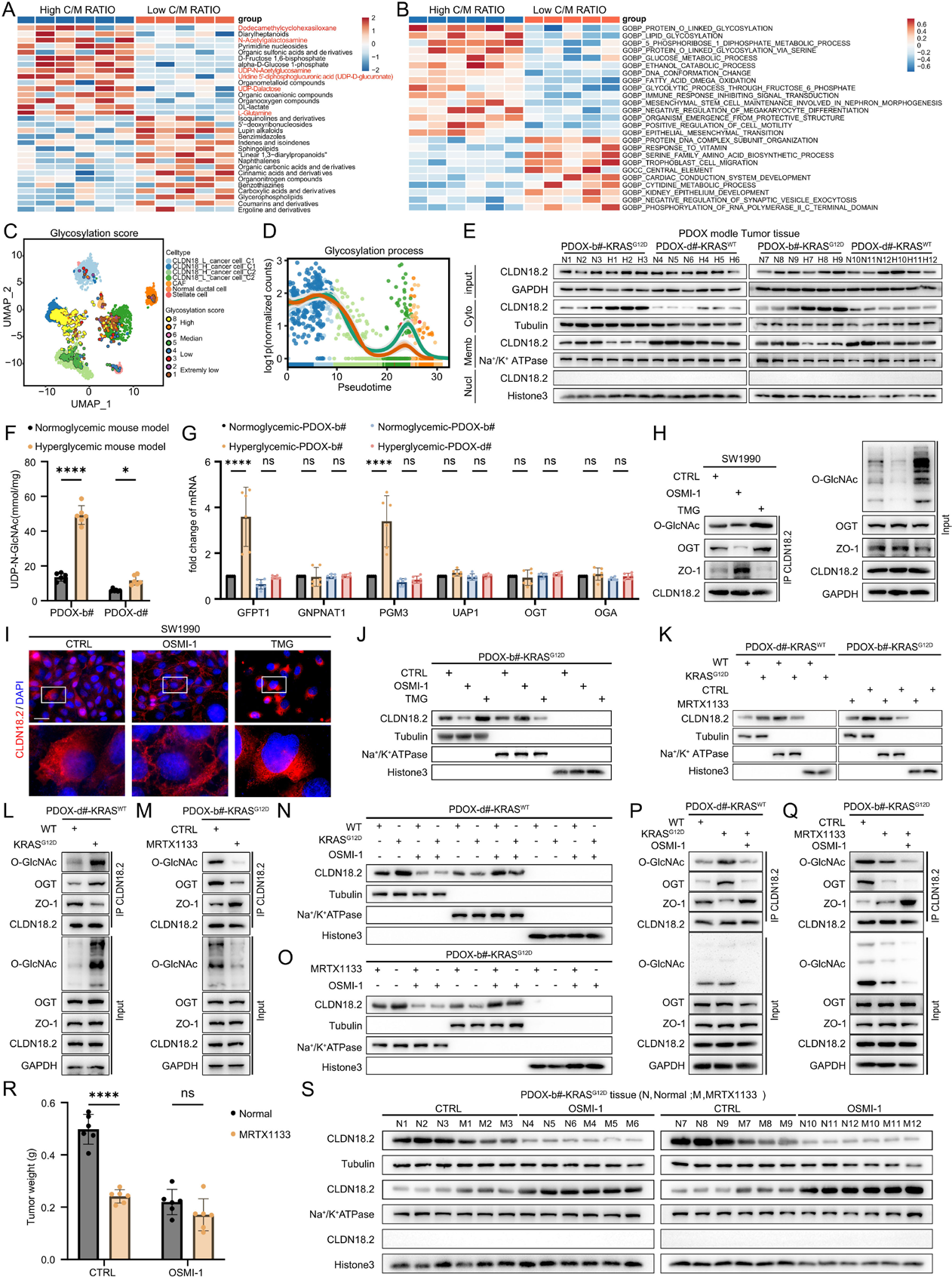
图2:KRAS突变和高血糖通过O-GlcNAc糖基化促进CLDN18.2的胞内滞留
CLDN18.2 O-GlcNAc糖基化促进PDAC转移并预测不良预后
研究团队进一步评估了O-GlcNAc糖基化的CLDN18.2(O-GlcNAc-CLDN18.2)的临床意义。多变量分析表明,O-GlcNAc-CLDN18.2是PDAC患者OS和RFS的强独立预后因素,其预测价值甚至超过总CLDN18.2水平。
表2:基于CLDN18.2 O-GlcNAc修饰状态的PDAC患者预后多因素分析
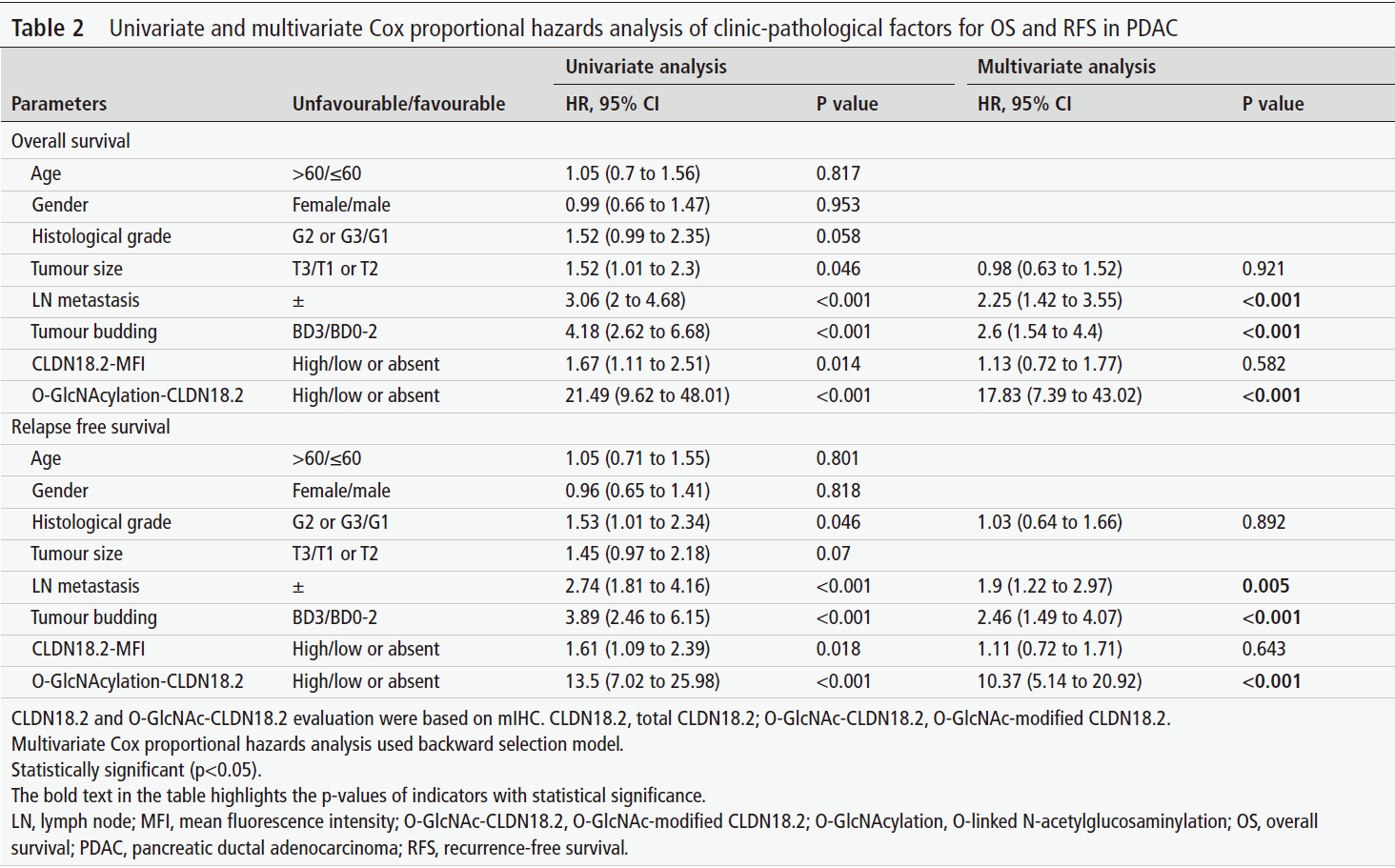
功能实验显示,在KPC(KRAS G12D; Trp53R172H; Pdx1-Cre)小鼠模型中,促进O-GlcNAc糖基化(使用TMG)可加速肿瘤生长、缩短生存期;而在KPC-Cldn18.2敲除小鼠中,这种促癌效应被消除。在PDO模型中,CLDN18.2的O-GlcNAc糖基化水平与类器官侵袭能力呈正相关。增强O-GlcNAc糖基化可促进上皮-间质转化(EMT)并降低对CLDN18.2靶向治疗的敏感性;反之,抑制O-GlcNAc糖基化则产生相反效果。
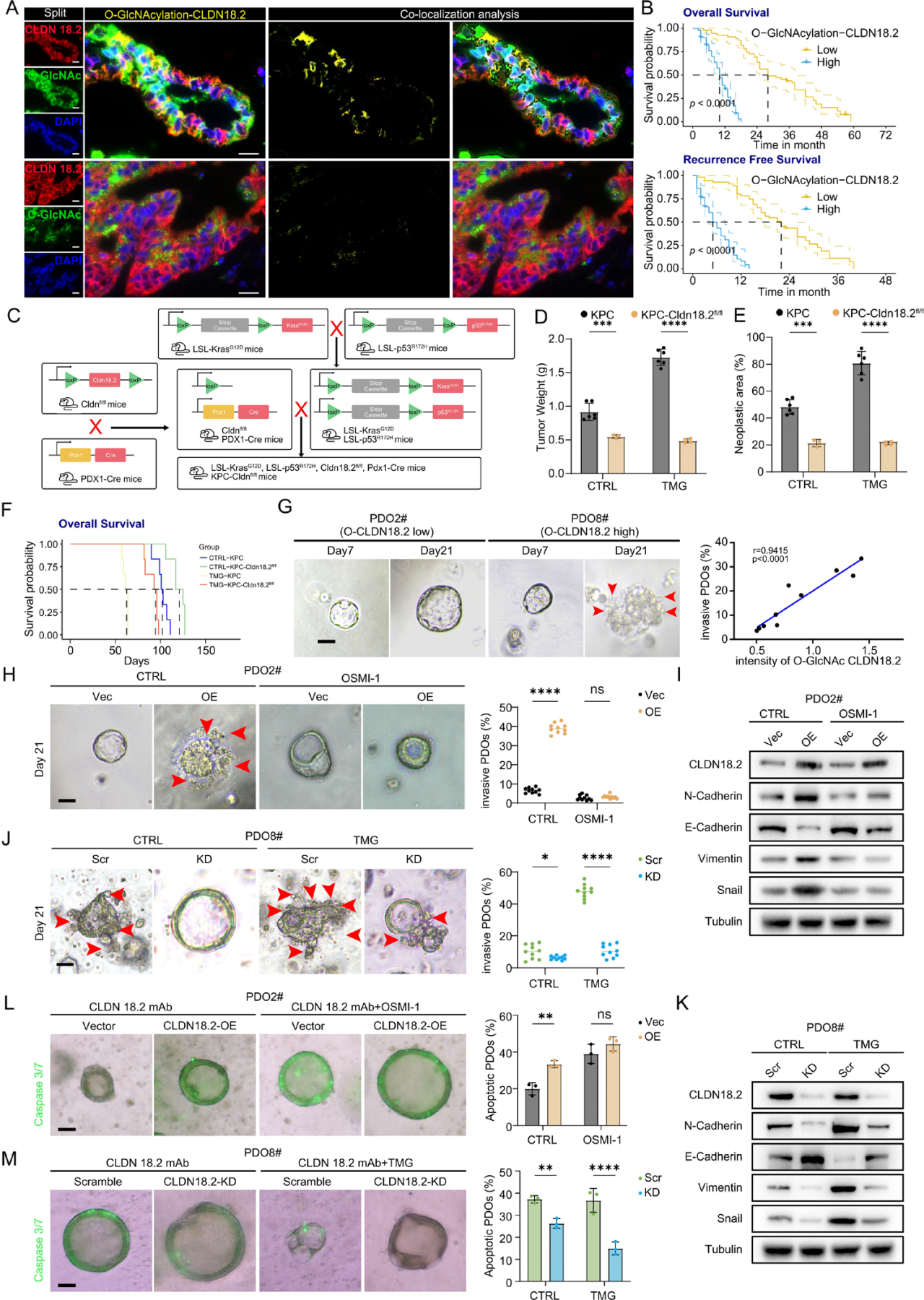
图3:CLDN18.2 O-GlcNAc糖基化诱导PDAC转移并预测不良预后
T204位点的O-GlcNAc糖基化是关键分子开关
通过质谱分析,研究团队确定了CLDN18.2上的潜在O-GlcNAc糖基化位点,并锁定了C末端的T204(苏氨酸204)。点突变实验证实,T204A突变显著降低了CLDN18.2的O-GlcNAc糖基化水平,并增加了其膜定位,同时增强了与ZO-1的相互作用。
进一步的功能实验表明,野生型CLDN18.2的过表达促进了PDAC细胞的伤口愈合、迁移、侵袭、伪足形成,而T204A突变则消除了这些促转移效应。在原位移植小鼠模型中,T204A突变组的肿瘤负荷和肝转移显著低于野生型组。这些发现确立了T204位点的O-GlcNAc糖基化是CLDN18.2介导肿瘤进展和转移的关键分子基础。
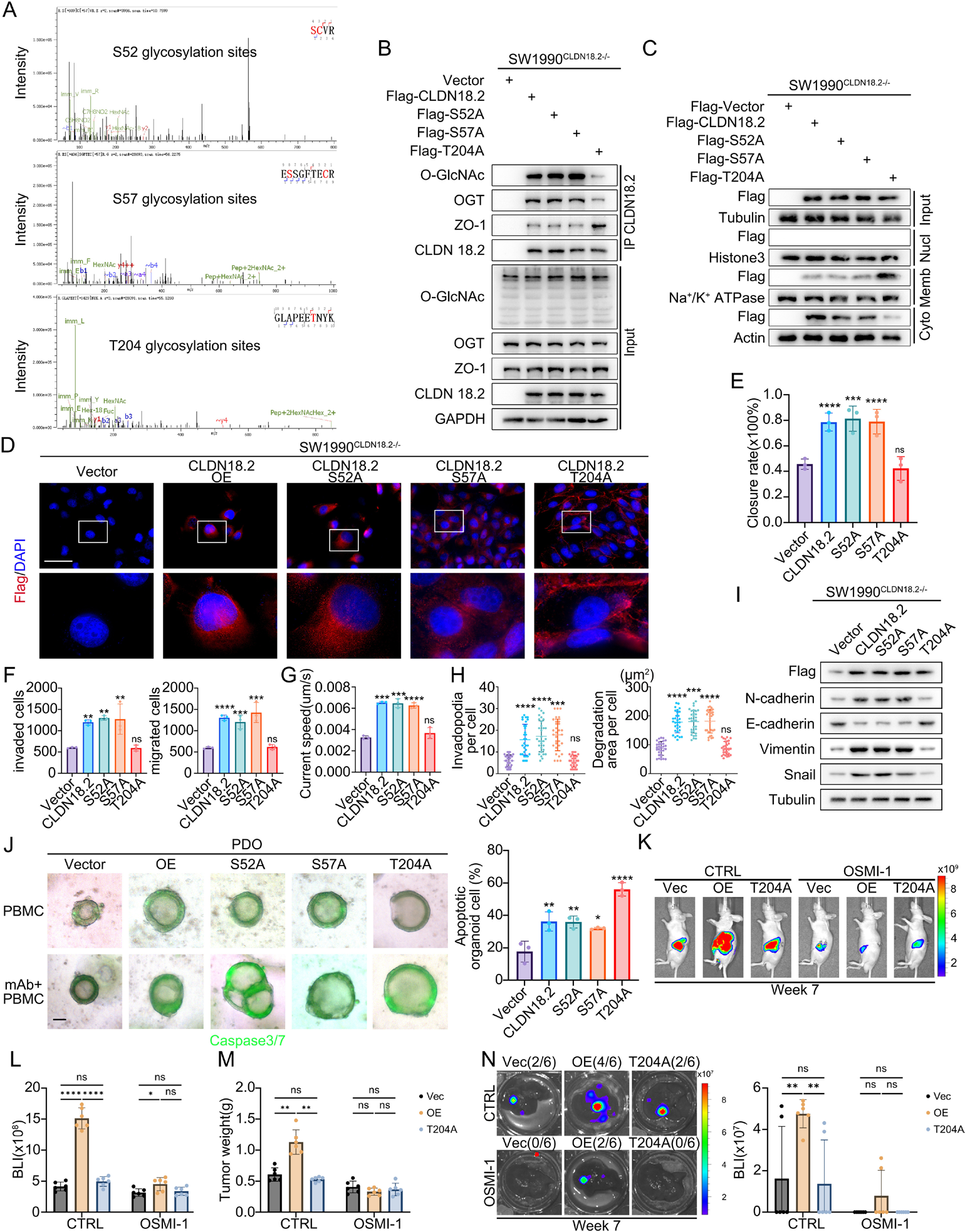
图4:CLDN18.2通过T204 O-GlcNAc糖基化促进PDAC进展
O-GlcNAc糖基化的CLDN18.2通过激活Src促进肿瘤进展
单细胞RNA测序分析显示,高表达CLDN18.2且糖基化活跃的肿瘤细胞簇富集于SRC_UP.V1_UP信号通路。免疫荧光和Western blot分析证实,CLDN18.2过表达显著增加了Src Y419的磷酸化水平(激活态)。
机制研究发现,O-GlcNAc糖基化的CLDN18.2与酪氨酸磷酸酶PTP1B的结合减少,导致CLDN18.2的酪氨酸磷酸化增强。这种磷酸化的CLDN18.2通过其磷酸化酪氨酸残基招募Src激酶的SH2结构域,从而触发Src激活。Src激活进一步促进了肿瘤细胞的迁移、侵袭和上皮-间充质转化(EMT)。在体内实验中,使用Src激活肽(YEEI)可以挽救CLDN18.2-T204A突变体因无法激活Src而丧失的促转移能力,证明O-GlcNAc糖基化的CLDN18.2主要通过激活Src驱动肿瘤进展。证实了Src激活是该通路下游的核心效应机制。
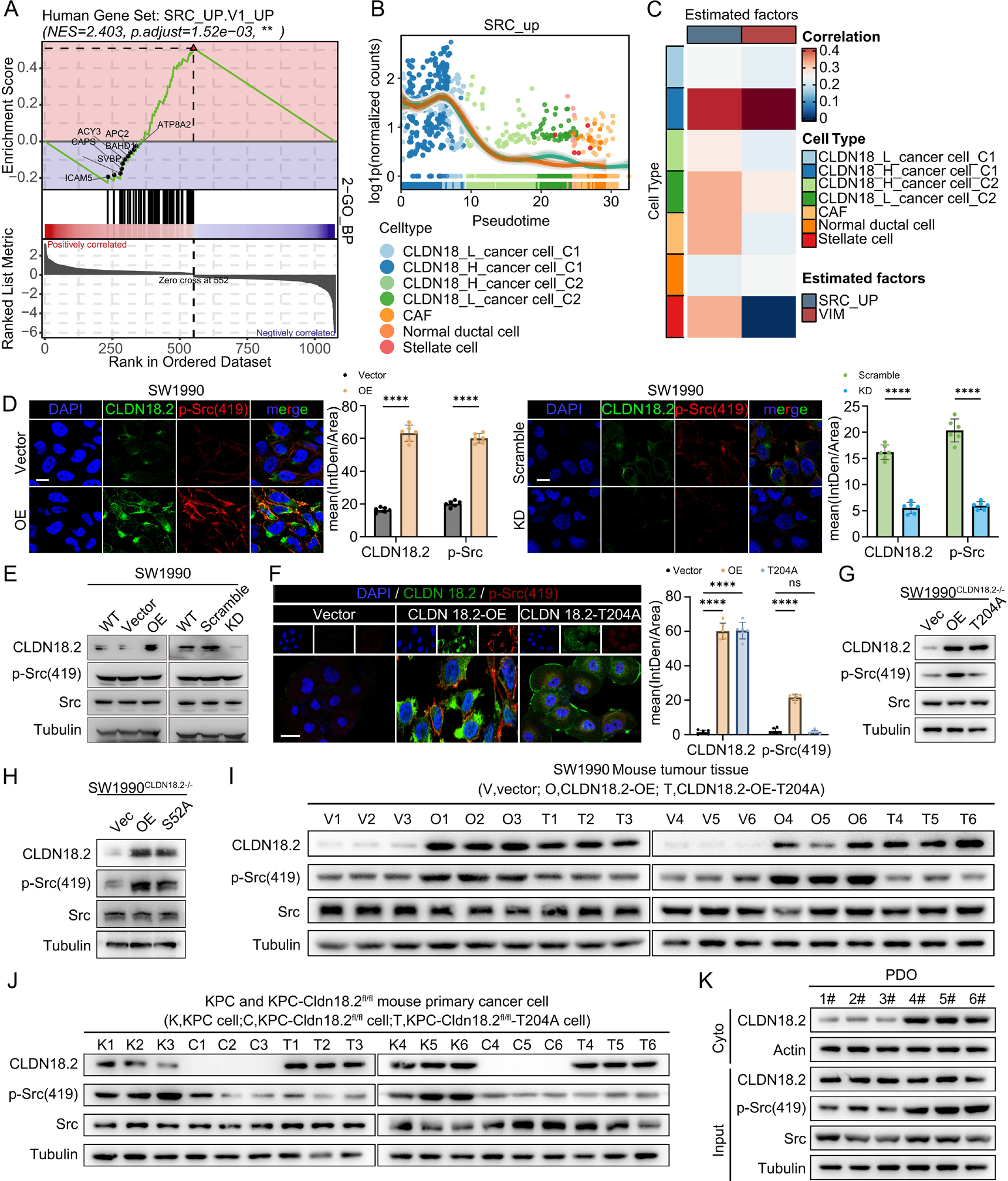
图5:CLDN18.2的T204-O-GlcNAc糖基化促进SrcY419磷酸化并激活Src
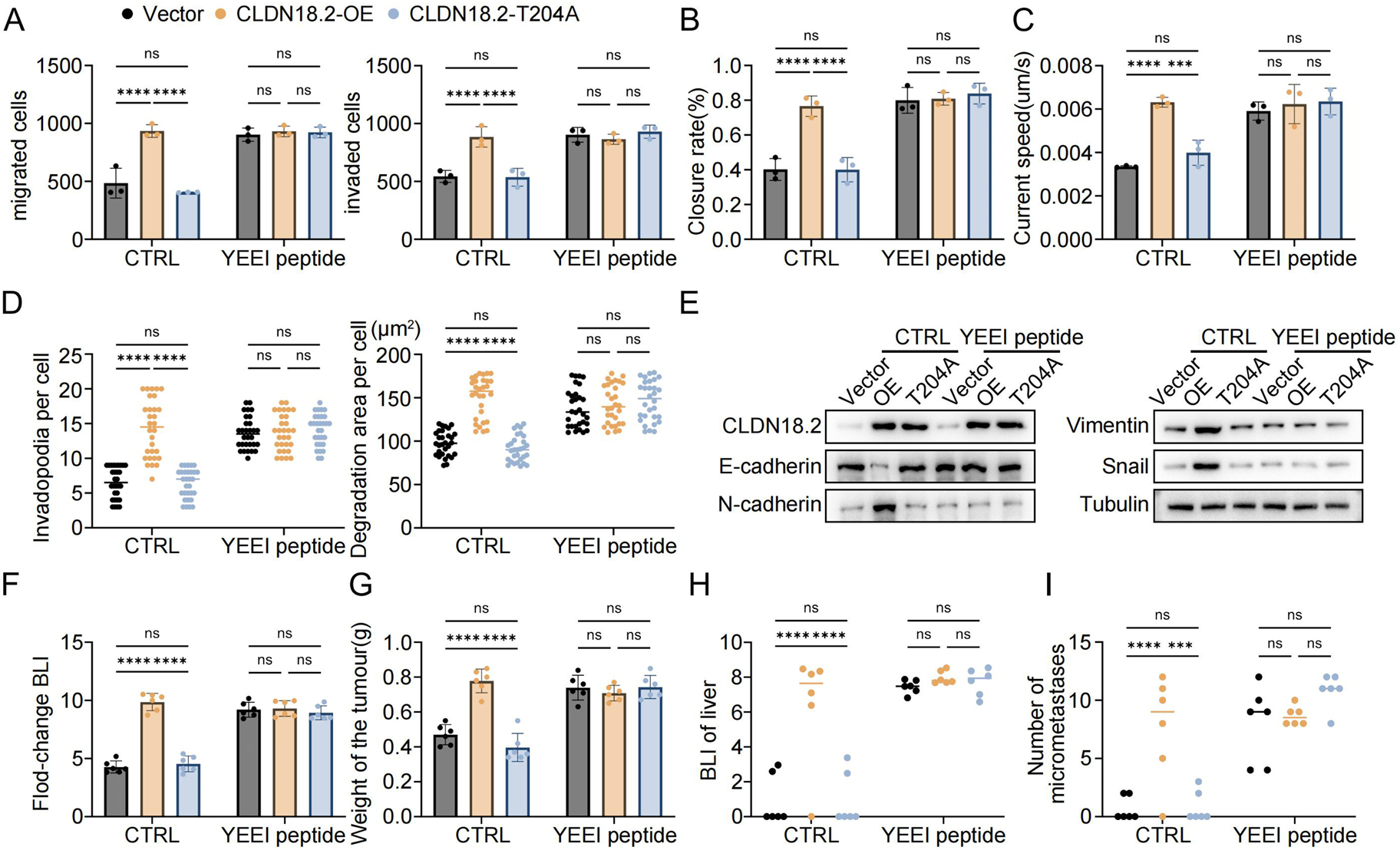
图6:O-GlcNAc糖基化的CLDN18.2通过激活Src促进胰腺癌进展
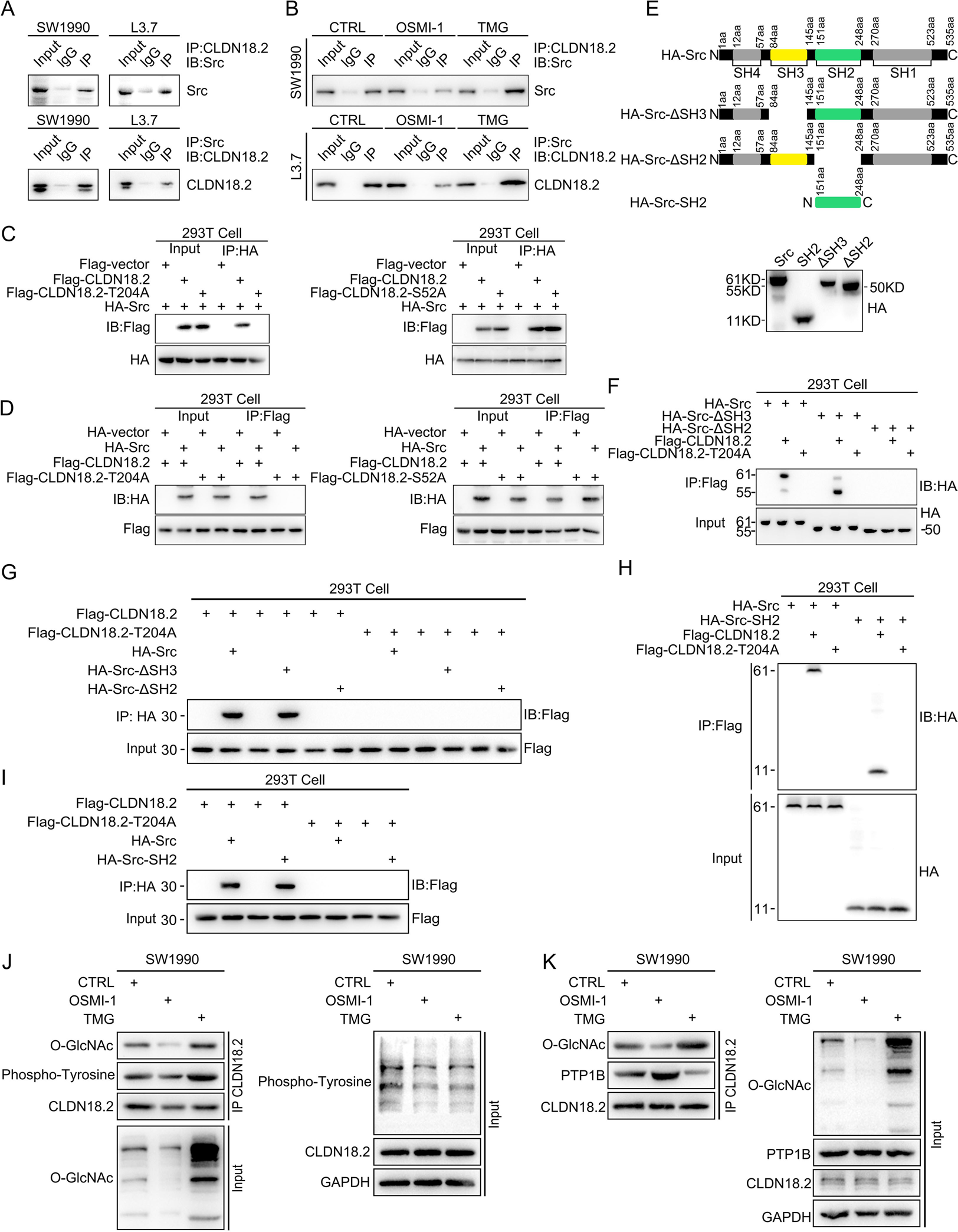
图7:CLDN18.2在T204位点的O-GlcNAc糖基化促进其酪氨酸磷酸化并增强与Src SH2结构域的相互作用
低剂量MRTX1133增效CLDN18.2靶向治疗
基于上述机制,研究团队提出了一种新的联合治疗策略:利用KRAS G12D抑制剂MRTX1133阻断KRAS信号,降低O-GlcNAc糖基化水平,从而恢复CLDN18.2的膜定位,增强CLDN18.2抗体的疗效。
体外实验显示,低剂量MRTX1133(200 nM,标准治疗剂量的1/4)即可有效抑制CLDN18.2的O-GlcNAc糖基化,其效果与高剂量相当。在KPC小鼠模型和原位hPDX模型中,低剂量MRTX1133与CLDN18.2单抗的联合治疗显著延长了小鼠的总生存期,大幅缩减了肿瘤体积和重量,并显著抑制了肝转移的发生。
更重要的是,相比于标准剂量的联合方案,低剂量MRTX1133联合CLDN18.2单抗并未增加毒副作用,肝功能损伤较轻,展现出了极佳的安全性。这表明,低剂量MRTX1133主要通过调节CLDN18.2的定位来发挥协同作用,而非单纯依赖其细胞毒性杀伤肿瘤。
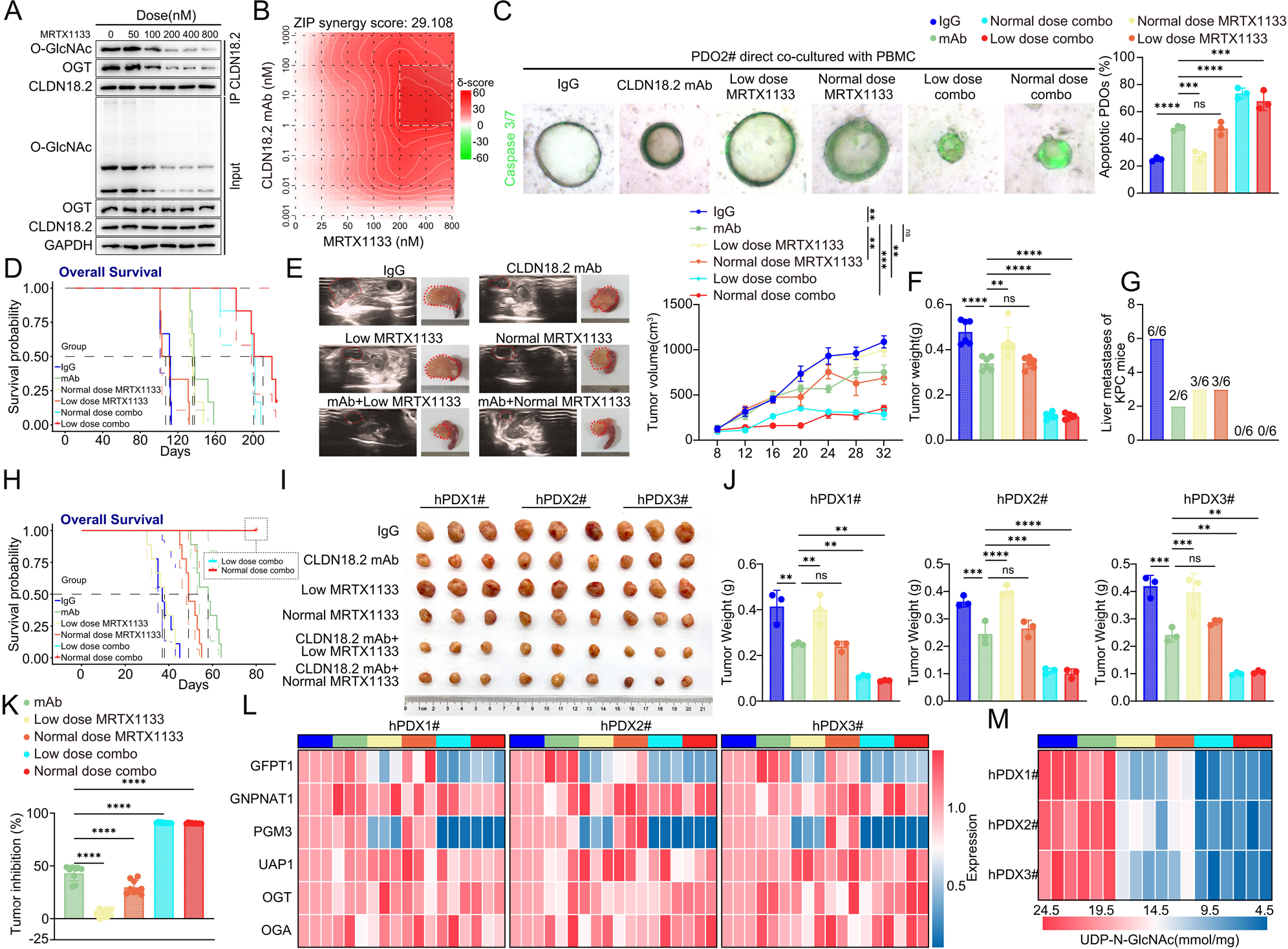
图8:低剂量MRTX1133在KRAS突变PDAC中与CLDN18.2靶向治疗协同作用
综上所述,该研究首次揭示了PDAC中CLDN18.2靶向治疗疗效受限的关键机制:KRAS突变和高血糖导致CLDN18.2 O-GlcNAc糖基化及胞质积聚,进而激活Src促进肿瘤进展;低剂量MRTX1133可逆转这一过程并增强靶向治疗疗效。
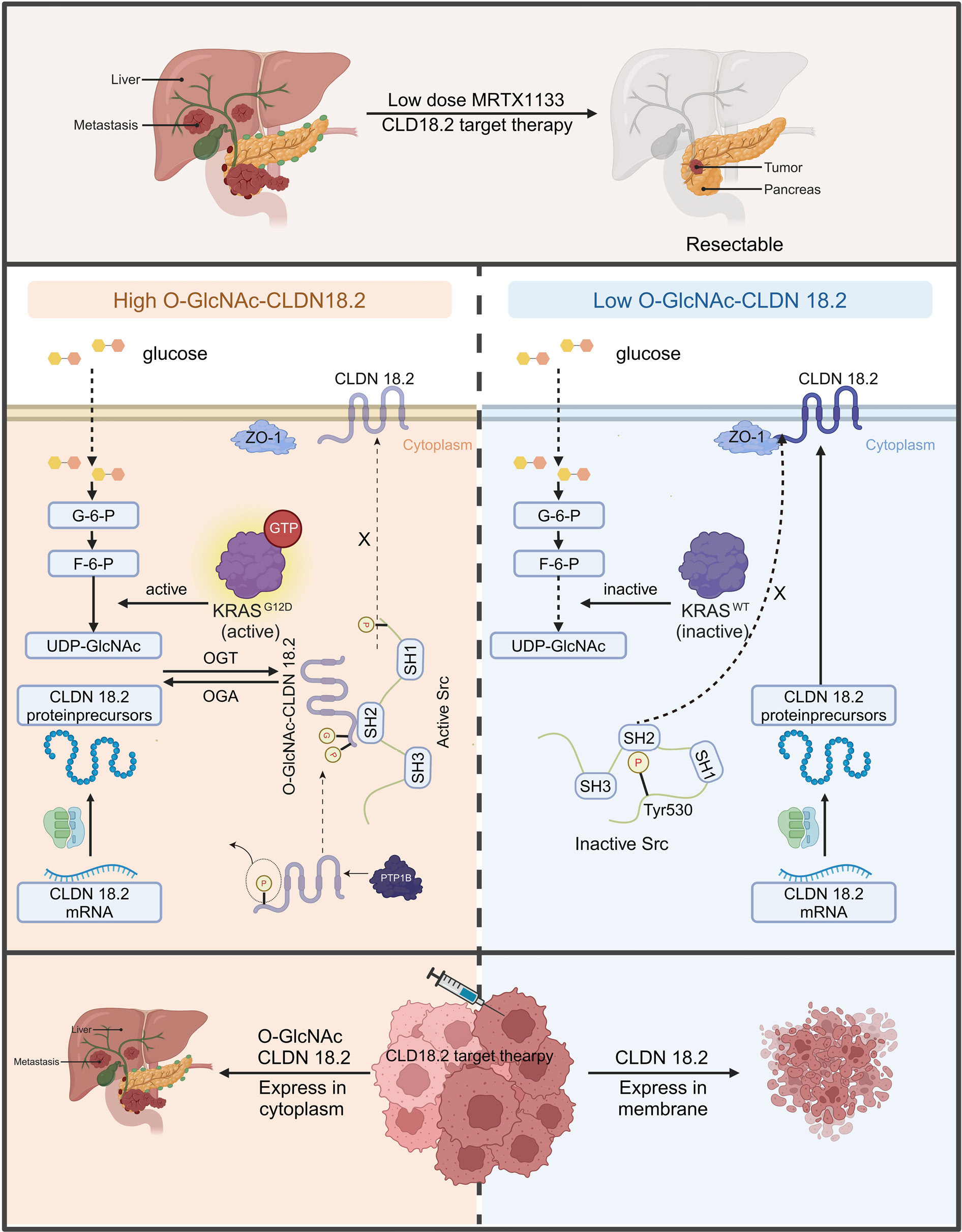
图9:研究机制示意图
研究结论
该研究不仅破解了PDAC中CLDN18.2靶向治疗疗效受限的“谜题”,更建立了 “分子机制-预后标志物-联合治疗”的完整转化链条。低剂量MRTX1133与CLDN18.2靶向治疗的协同方案,为KRAS突变PDAC这一“难治性肿瘤”提供了全新的治疗思路,有望推动PDAC精准治疗迈入新的阶段。
来源:肿瘤界