2026年1月10日,中山大学肿瘤防治中心黄慧强教授、复旦大学附属肿瘤医院陶荣教授等领衔在THE LANCET发表了EPCORE FL-1全球III期临床试验结果,题为“Epcoritamab, lenalidomide, and rituximab versus lenalidomide and rituximab for relapsed or refractory follicular lymphoma (EPCORE FL-1): a global, open-label, randomised, phase 3 trial”。该研究头对头比较了epcoritamab(CD3xCD20双抗)联合来那度胺+利妥昔单抗(R²方案)与R²方案治疗复发/难治滤泡性淋巴瘤的疗效与安全性。研究结果显示,联合方案显著提升患者完全缓解(CR)率和无进展生存期(PFS),且安全性可控,这标志着首个基于双特异性抗体的联合方案有望成为该类患者二线及以上治疗的新标准。

研究背景
滤泡性淋巴瘤(FL)是第二常见的B细胞非霍奇金淋巴瘤。尽管一线化疗免疫疗法能使患者获得持久缓解,但一旦复发,后续治疗的缓解期会逐线缩短。对于至少接受过一线含抗CD20单抗化疗后复发或难治的FL患者,无化疗的来那度胺联合利妥昔单抗(R²)方案是国际公认的标准治疗。然而,在临床试验中,仅约半数的患者能从R²方案中获得完全缓解,真实世界研究也观察到类似的缓解率。这凸显了临床对于能够诱导更深、更持久缓解,从而改善长期结局的新疗法的迫切需求。
epcoritamab是一种皮下给药、同时靶向B细胞抗原CD20和T细胞抗原CD3的双特异性抗体,已在多国获批用于二线以上FL的单药治疗。其作用机制是通过桥接CD20阳性的恶性B细胞与CD3阳性的T细胞,激活T细胞介导的细胞毒作用,清除肿瘤细胞。临床前研究表明,epcoritamab与利妥昔单抗因靶向CD20的不同表位,联合使用时抗肿瘤活性互不干扰,且epcoritamab还能促进自然杀伤细胞活化,增强利妥昔单抗介导的细胞毒性。而来那度胺可增强T细胞和自然杀伤细胞的增殖与活化。这三种药物独特且互补的作用机制,为在复发/难治FL患者中实现更强的抗淋巴瘤活性和更佳的临床结局提供了理论可能。
在Ib/II期EPCORE NHL-2试验中,固定疗程的epcoritamab联合R²方案在复发/难治FL患者中显示出深度且持久的缓解(总缓解率96%,完全缓解率88%,估计24个月无进展生存率76%)。基于这些鼓舞人心的结果,EPCORE FL-1试验旨在头对头比较epcoritamab+R²方案与R²方案的疗效与安全性。
研究设计
EPCORE FL-1是一项在全球30个国家、189个中心开展的多国、开放标签、随机III期试验。研究纳入了年龄≥18岁、经组织学确诊为CD20阳性经典FL(II、III或IV期)、至少接受过一线含抗CD20单抗化疗后复发/难治、ECOG体能状态0-2分、至少符合一项GELF治疗标准且根据Lugano标准至少有一个可测量病灶的患者。
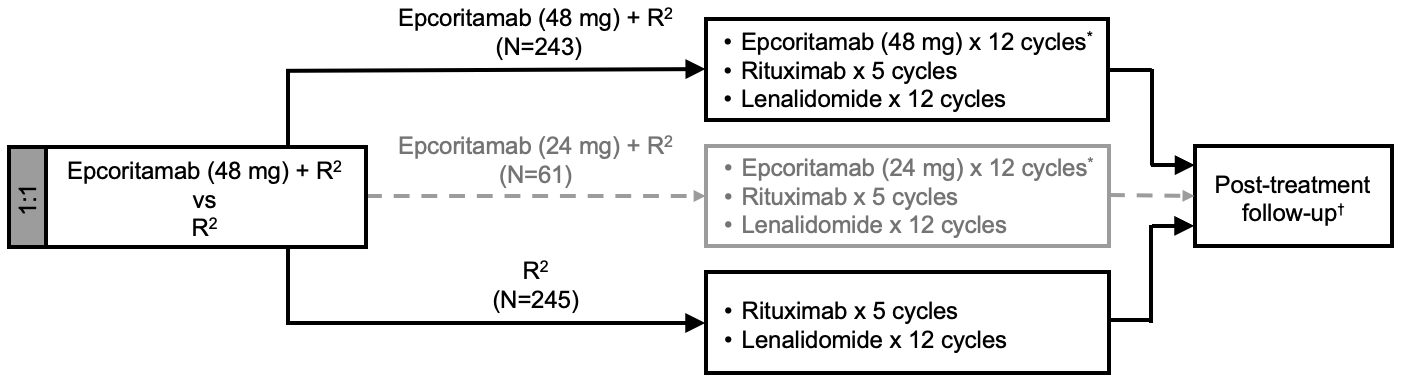
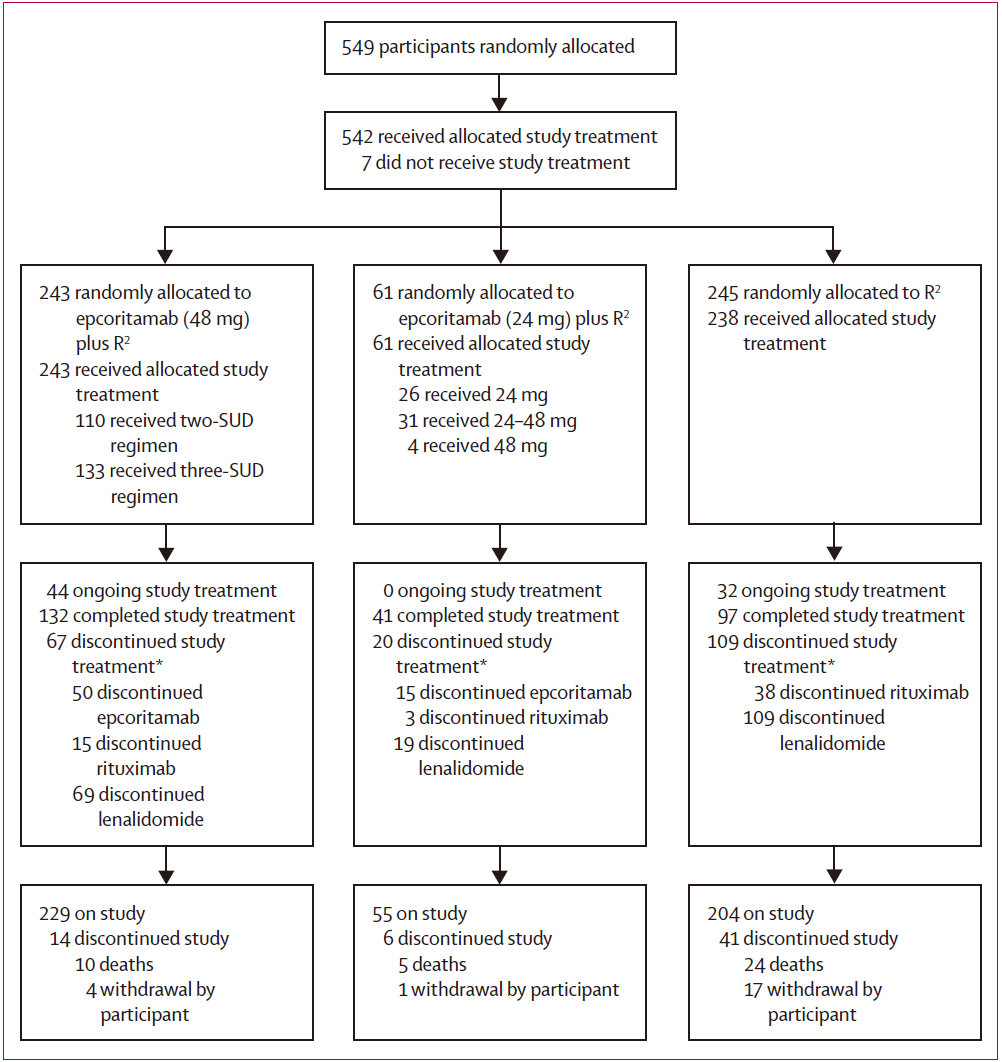
研究共入组488例患者,按1:1随机分配至:
试验组(n=243):epcoritamab(48mg)+R²方案
对照组(n=245):R²方案
研究的双重主要终点是由独立审查委员会(IRC)根据2014年Lugano标准评估的总缓解率和无进展生存期(PFS)。关键次要终点包括完全缓解(CR)率、总生存期(OS)、微小残留病(MRD)阴性等。
试验设计
(由于前期EPCORE NHL-2试验数据显示48mg剂量疗效更优,本研究中的24mg剂量组提前停止招募)
flowchart
研究结果
截至2025年5月24日的数据分析时,中位随访时间为14.8个月(IQR 11.4-19.0)。
疗效结果
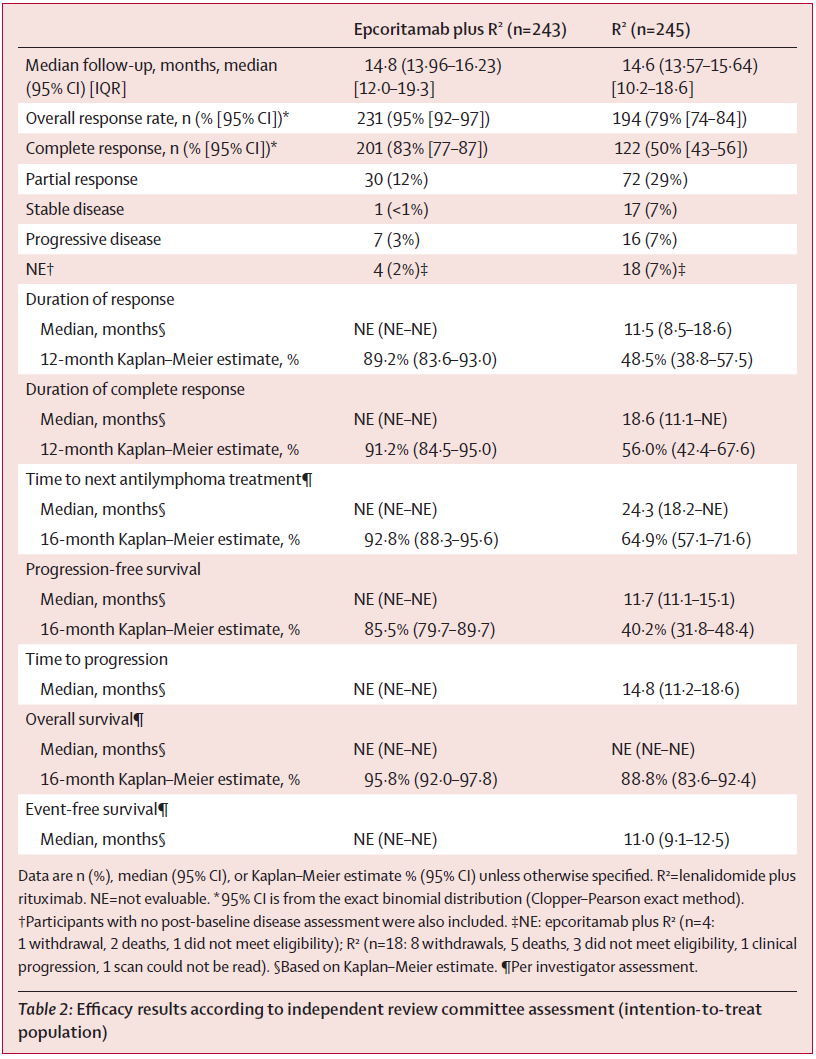
总缓解率:epcoritamab+R²组IRC评估的总缓解率为95%(95%CI 92-97),显著高于R²组的79%(95%CI 74-84)(P<0.0001)。
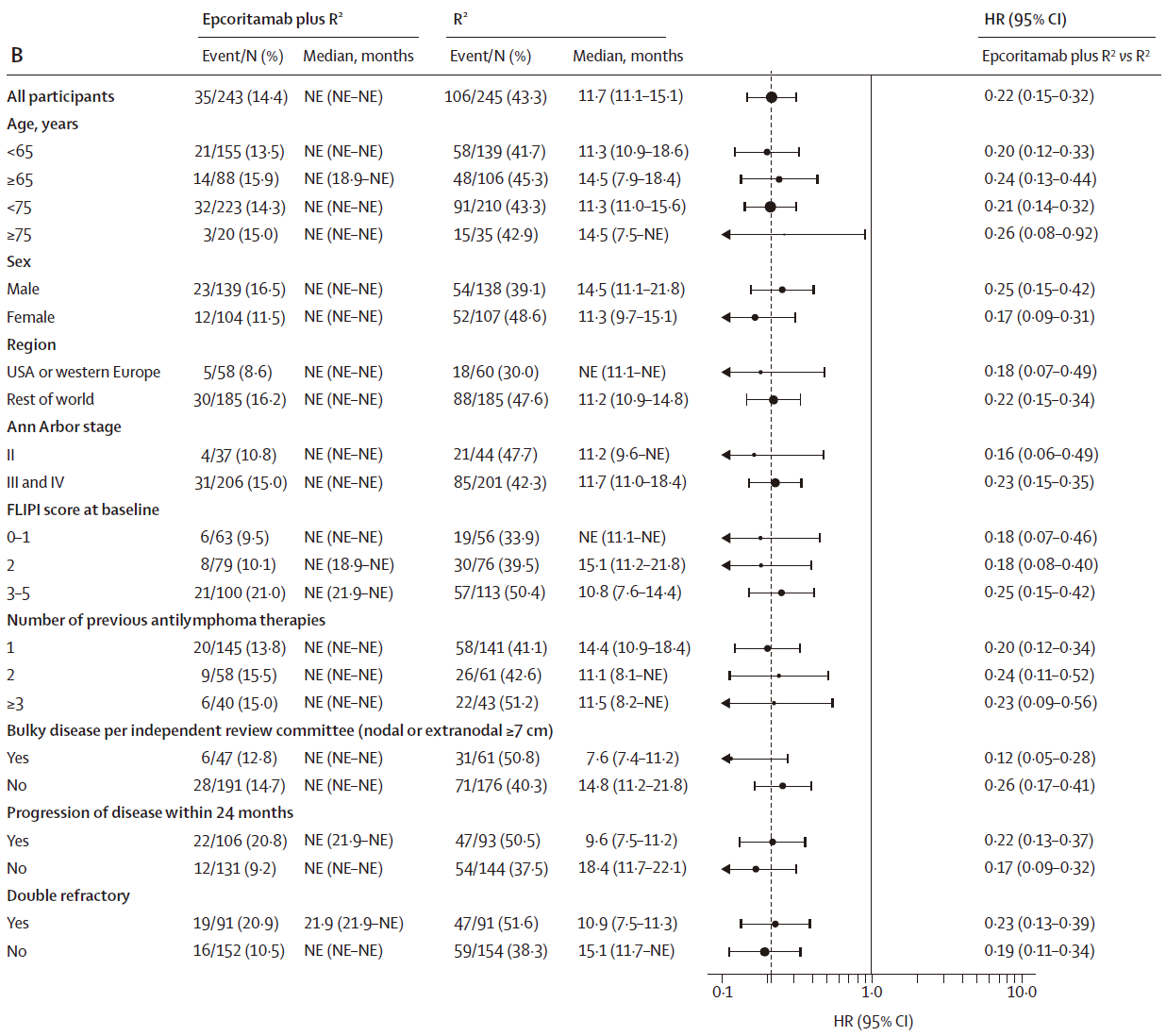
CR率:epcoritamab+R²组为83%(95%CI 77-87),同样显著高于R²组的50%(95%CI 43-56)(P<0.0001)。这一完全缓解获益在所有预设的亚组中均得以体现。
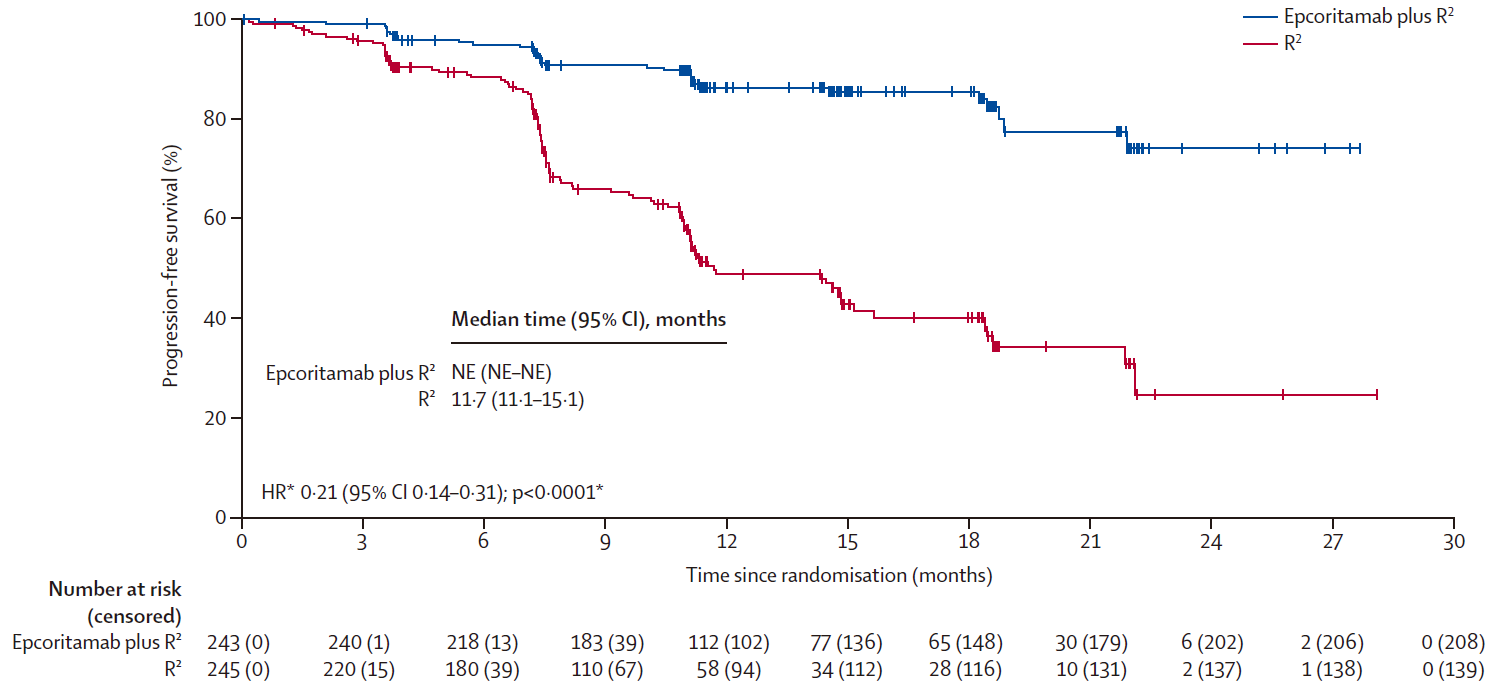
PFS:与R²组相比,epcoritamab+R²组PFS更长(HR=0.21,95%CI 0.14-0.31,P<0.0001)。中位PFS,epcoritamab+R²组未达到(NE),R²组中位PFS为11.7个月(95%CI 11.1-15.1个月);预估16个月PFS,epcoritamab+R²组为85.5%,R²组为40.2%。PFS的获益同样跨越所有预设亚组。
PFS
各亚组PFS
缓解持续时间(DOR):中位DOR,epcoritamab+R²组未达到,而R²组为11.5个月。12个月DOR率,epcoritamab+R²组89.2%,R²组48.5%。此外,epcoritamab+R²组显著延长了至下次抗淋巴瘤治疗的时间(HR=0.15,95%CI 0.09-0.27,P<0.0001)。
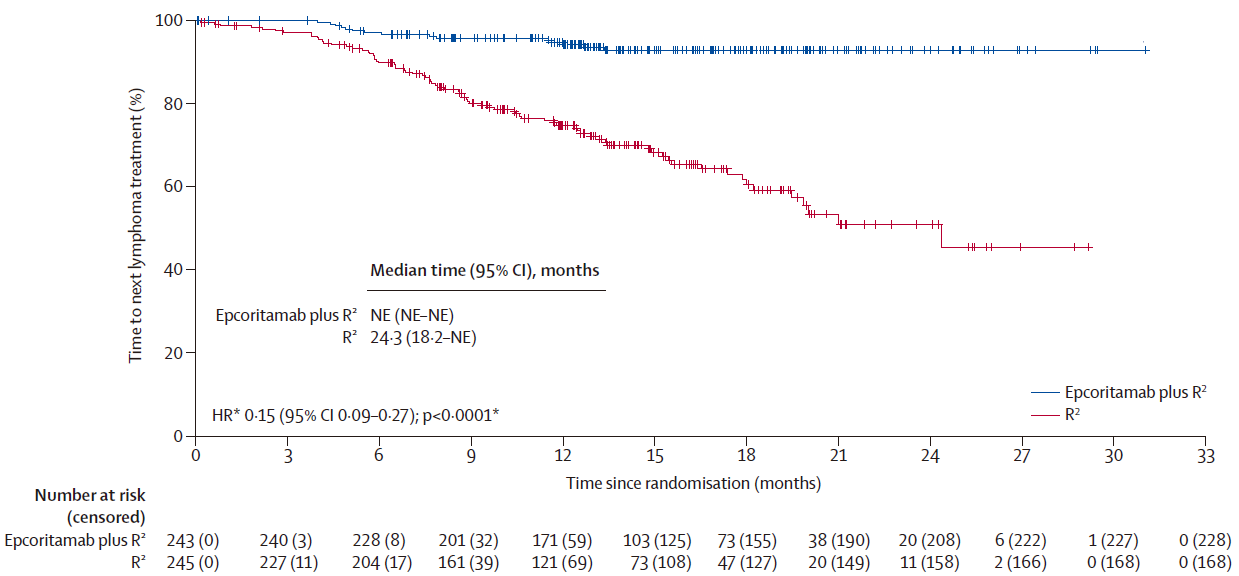
至下次抗淋巴瘤治疗时间
OS:两组中位OS均未达到,但epcoritamab+R²组显示出优于R²组的生存获益趋势,16个月OS率:95.8% vs 88.8%(HR=0.38,95%CI 0.18-0.80,P=0.0039)。
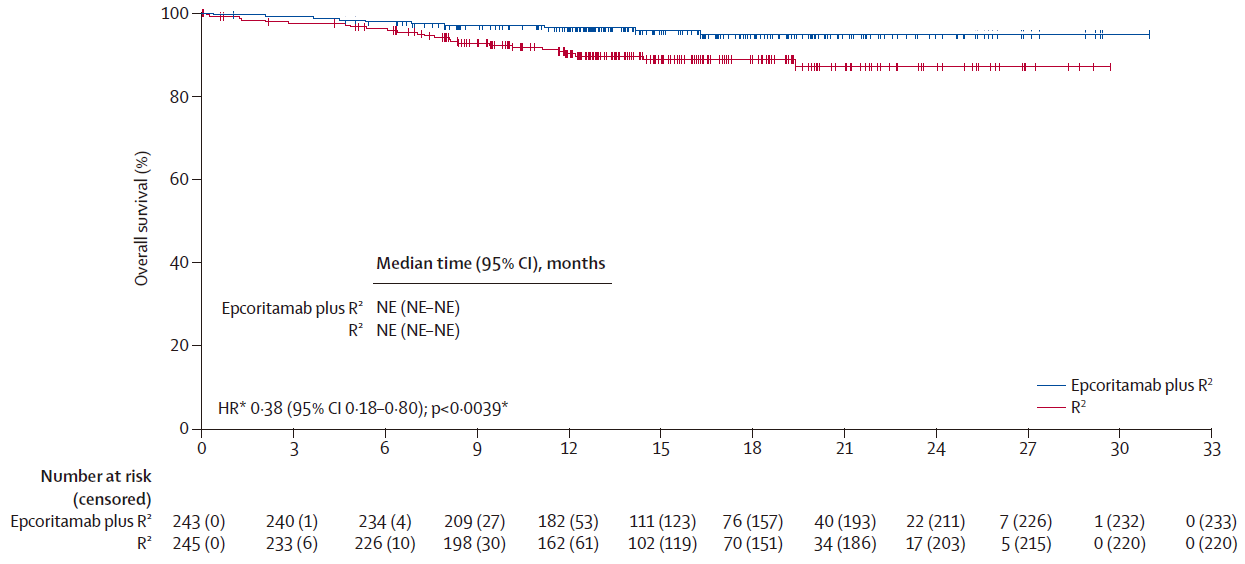
OS
表:疗效结果
安全性结果
epcoritamab+R²组虽然带来了显著的疗效提升,但也伴随着更高的不良反应发生率,这与三种药物已知的毒性特征相符,未发现新的安全性信号:
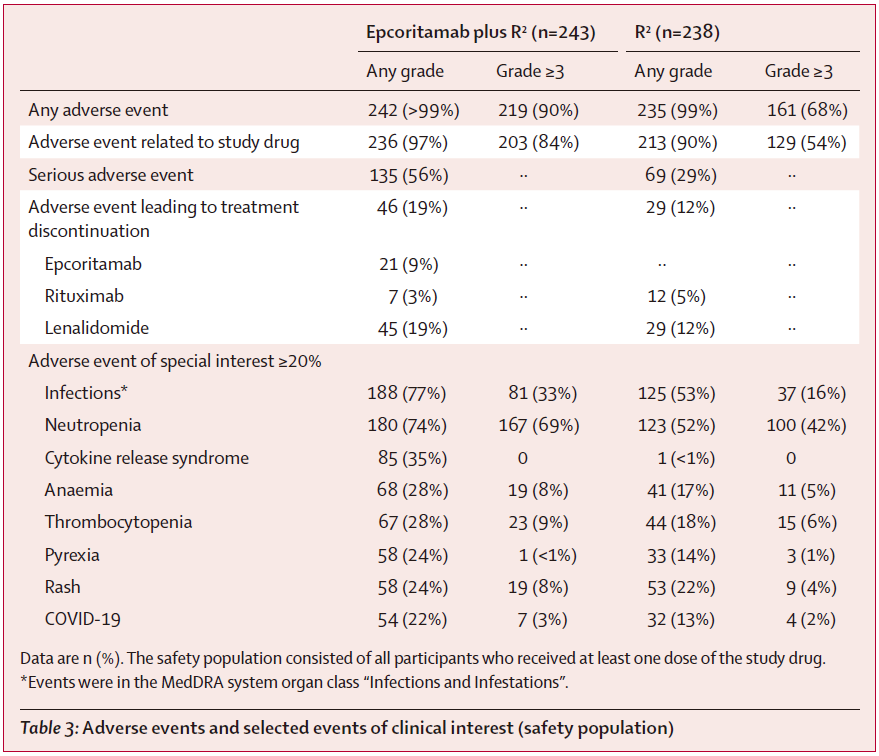
总体安全性:epcoritamab+R²组≥3级不良事件的发生率为90%,高于R²组的68%。严重不良事件发生率分别为56%和29%。导致治疗中断的任何级别不良事件分别为19%和12%。
血液学毒性:中性粒细胞减少症是最常见的≥3级不良事件,epcoritamab+R²组发生率为69%(R²组42%),其中发热性中性粒细胞减少发生率分别为6%和3%。
感染:任何级别的感染在epcoritamab+R²组更常见(77% vs 53%),≥3级感染发生率分别为33%和15%。
细胞因子释放综合征(CRS):epcoritamab+R²组CRS发生率为35%,均为1-2级,且所有CRS事件均已缓解。采用三阶梯给药方案的患者CRS发生率(26%)显著低于2步方案(45%)。
生活质量:通过FACT-Lym量表评估,两组患者在治疗期间的生活质量均得以维持,从基线的变化均在最小重要差异阈值内,表明联合方案在带来显著疗效的同时,并未损害患者的生活质量。
表:安全性结果
研究结论
在这项针对至少接受过一线治疗的FL患者的III期试验中,主要分析表明,固定疗程的epcoritamab+R²方案优于标准治疗R²方案,其完全缓解率高,并能大幅降低疾病进展或死亡风险,且在门诊环境下安全性可控。在无化疗方案带来更长缓解和潜在治愈可能性的新时代,epcoritamab联合R²方案有望取代R²方案,成为滤泡性淋巴瘤二线或后续治疗的新标准。未来仍需长期随访数据进一步验证OS获益,并探索联合方案在更早线治疗中的应用价值。
来源:肿瘤界