REVIEW | Open Access
Mengru Wang, Zhen Qin, Xiu-Wu Bian, Yu Shi
Cancer Communications. 2025
https://doi.org/10.1002/cac2.70053
文章亮点
1.阐明了CAR-M的关键设计要素,深入探讨了CAR结构的迭代优化以及巨噬细胞来源对CAR-M制备的影响。
2.系统综述了CAR-M的研发进程与组合策略,从临床前模型中的有效性,推进到早期临床试验的初步结果,并探讨了其潜在的联合治疗策略。
3.前瞻性地展望了CAR-M的发展趋势,未来将聚焦于通过创新结构设计、优化工艺与应用新兴技术,系统性提升其特异性、适应性、有效性、安全性,并积极拓展在非肿瘤疾病领域的应用前景。
文章简介
巨噬细胞在多种实体肿瘤中广泛浸润,并表现出功能上的高度多样性,使其成为肿瘤免疫治疗中的重要调控靶点。重塑巨噬细胞表型已成为当前研究的关键方向之一。近年来,利用嵌合抗原受体(CAR)技术改造巨噬细胞,赋予其特异性抗肿瘤能力,显示出良好的治疗潜力,尤其在增强靶向吞噬能力方面表现突出。此外,嵌合抗原受体巨噬细胞(CAR-M)还能通过分泌促炎细胞因子、呈递肿瘤抗原等方式激活并协调适应性免疫,进而诱导细胞毒性T细胞反应。这些多重机制使CAR-M有望成为治疗难治性实体肿瘤的有效免疫疗法。
陆军军医大学西南医院病理研究所卞修武/时雨团队在Cancer Communications上发表了题为“Harnessing chimeric antigen receptor macrophages against solid tumors”的综述,系统阐述了CAR-M的设计原则、最新研究进展及其联合治疗策略,并对早期临床试验数据进行了分析。文章还展望了CAR-M在非肿瘤疾病领域的潜在应用,并借鉴CAR-T技术的发展趋势对未来方向作出预测。随着新技术不断融合,CAR-M的进一步发展有望为肿瘤免疫治疗提供新的思路与策略。
图文导读
1. CAR-M对抗肿瘤的独特优势
CAR-M在抗肿瘤作用中的独特优势在于其多元化的杀伤机制。相较于CAR-T细胞,CAR-M不仅能够通过CAR识别靶点后直接介导肿瘤细胞的吞噬作用并发挥细胞毒性,还能在吞噬过程中处理肿瘤抗原,进而将其呈递给T细胞,激活适应性免疫应答。此外,CAR-M可分泌一系列促炎细胞因子,从而塑造免疫支持性微环境。这些细胞因子能够进一步增强T细胞与自然杀伤(NK)细胞的活性,并将肿瘤相关巨噬细胞从促肿瘤表型逆转为抗肿瘤表型。相比之下,CAR‑T细胞的作用机制主要依赖于其细胞毒性以及自身活化与增殖所带来的抗肿瘤效果。
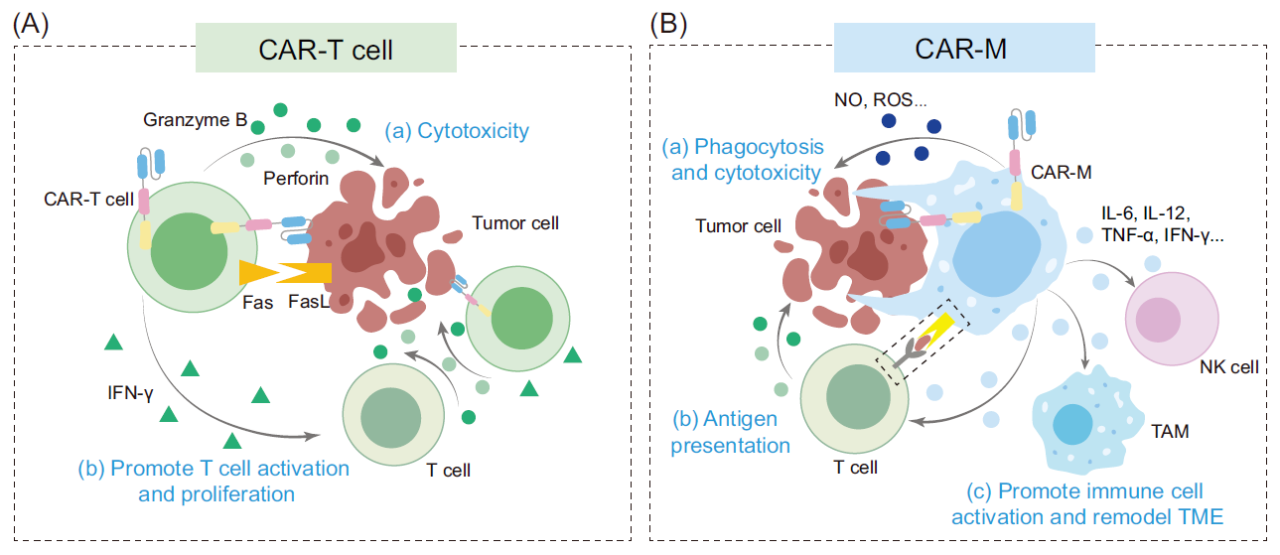
图1. CAR-T细胞和CAR-M抗肿瘤机制的差异
2. CAR-M设计优化
在CAR结构设计方面,其作为一种模块化跨膜蛋白,能够特异性识别肿瘤抗原并引导免疫细胞发挥抗肿瘤功能。典型CAR包含四个结构域:胞外抗原识别区、铰链区、跨膜区以及胞内信号域。尽管CAR结构已发展至第五代,其演进脉络多源于CAR‑T研究,但对CAR‑M的设计仍具重要参考意义。目前报道的CAR‑M构建体以第一代和第二代为主,其在结构上显示出与CAR‑T不同的设计逻辑。首先,胞内信号域的选择原则存在显著差异:CAR‑T细胞的充分活化通常需要共刺激域(如CD28或4‑1BB)与CD3ζ协同作用,而CAR‑M的吞噬功能仅需单个携带免疫受体酪氨酸激活基序(ITAM)的胞内域即可启动,共刺激域仅作为辅助信号。常用于激活CAR‑M的胞内域包括CD3ζ、FcRγ和Megf10等,抗原识别后诱导ITAM磷酸化,进而启动下游吞噬信号——该单域设计为第一代CAR‑M的典型特征。其次,CAR‑M还可被进一步工程化以重塑肿瘤微环境并增强T细胞免疫反应,而CAR‑T则以细胞毒性为主要机制。例如,将CD3ζ与Toll样受体4的TIR结构域融合,可在保留吞噬活性的同时促进促炎因子分泌,形成免疫刺激微环境,此类双域结构则对应第二代CAR‑M。
图2. CAR-T细胞与CAR-M的CAR结构演变
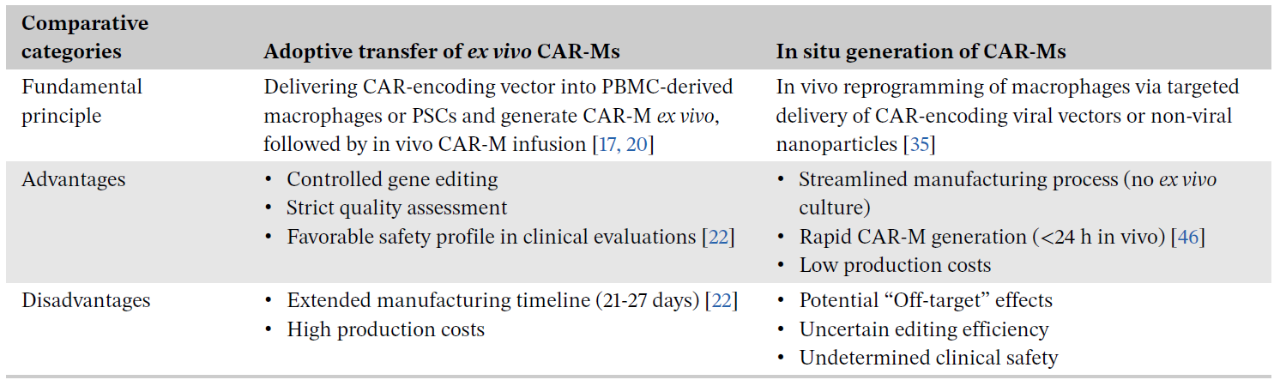
关于CAR‑M的细胞来源,目前临床试验多采用自体外周血单个核细胞(PBMC)分化的单核/巨噬细胞。然而,该来源细胞存在体外扩增能力有限、CAR递送及靶向基因编辑效率低等问题。为此,研究人员将目光转向多能干细胞(PSC),其具有强大的体外增殖能力和易于基因编辑的特性,但异体PSC来源的CAR‑M可能引发宿主免疫排斥,安全性尚待评估。另一新兴策略是开展体内原位编辑,直接将巨噬细胞在患者体内改造成CAR‑M,该方式有望显著节约成本与时间,但其安全性问题仍需重点关注。
表1. 不同细胞来源的CAR-Ms的比较
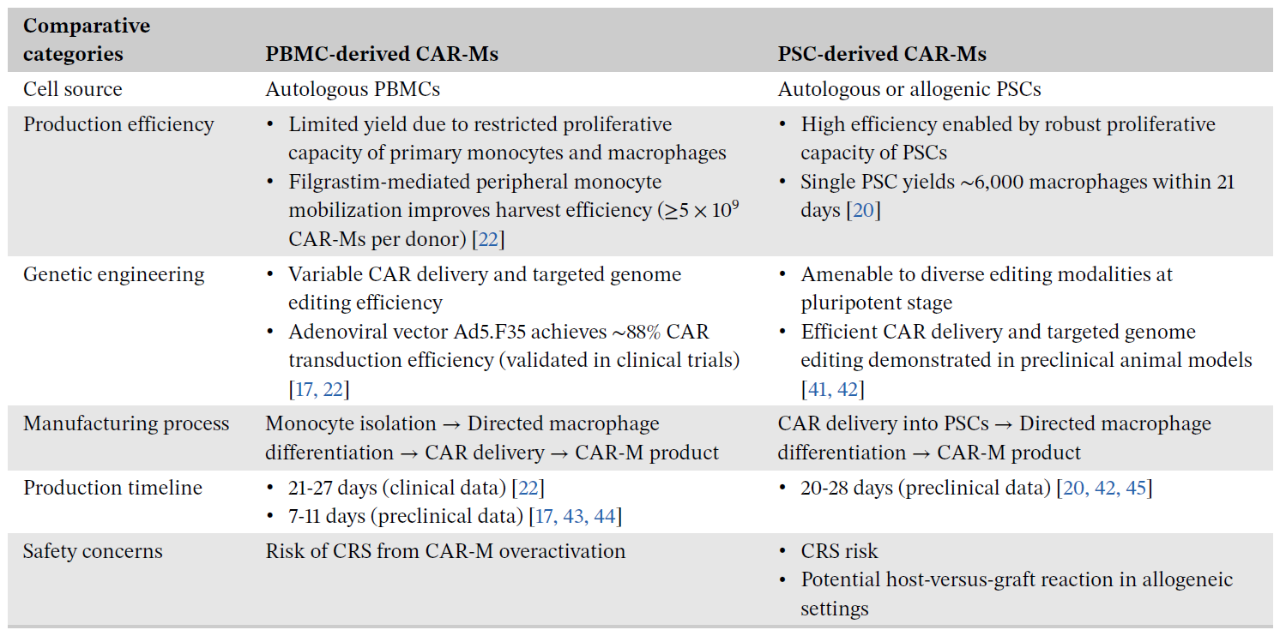
表2. 体外和原位CAR-M治疗方式的比较
3. CAR-M临床前与临床研究进展
自Morrissey等人首次证实CAR技术可成功应用于巨噬细胞以来,针对多种肿瘤模型的CAR-M临床前研究取得了显著进展。目前研究多聚焦于靶向肿瘤相关抗原(TAA),如乳腺癌中的人表皮生长因子受体2(HER2)及卵巢癌中的间皮素(MSLN)等。在卵巢癌、乳腺癌、胶质母细胞瘤、胰腺癌等多种实体肿瘤的移植瘤模型中,CAR-M疗法已展现出明确的抗肿瘤效果。然而,在全身性给药或治疗晚期恶性肿瘤时,其疗效仍可能受限。目前,学界对CAR-M在外周血中的存续时间及其在体内的整体分布特征认知仍较有限,亟需进一步研究以追踪输注后CAR-M的长期动态。
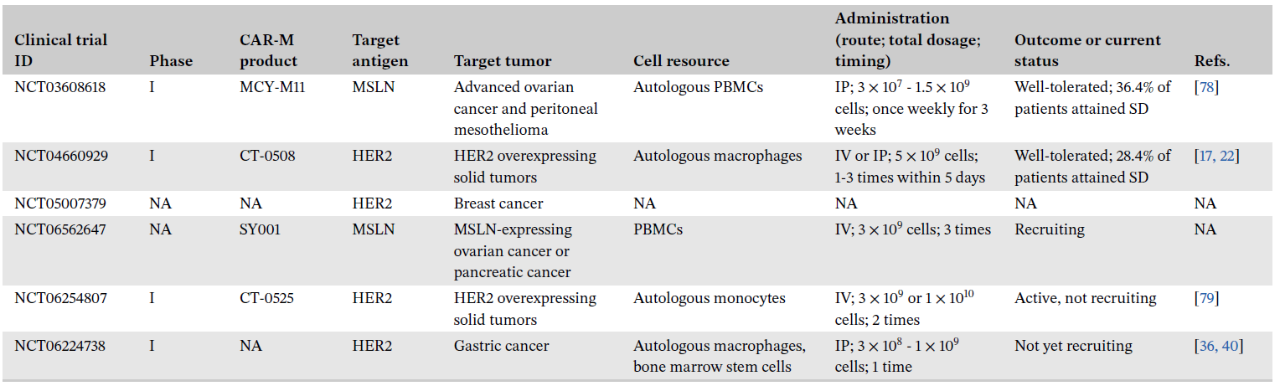
截至2025年5月31日,ClinicalTrials.gov上注册的CAR-M临床试验共6项,包括1项观察性研究和5项干预性研究。所有这些CAR-M产品均靶向HER2或MSLN过度表达的复发/难治性实体肿瘤。给药途径涵盖静脉输注或腹腔注射,单患者总细胞输注剂量范围在3×10⁷至1×10¹⁰个细胞之间。其中两项试验(NCT04660929与NCT06562647)探索了CAR-M与抗PD-1疗法的联合策略。试验主要终点为安全性及耐受性评估,次要终点则包括疗效与药代动力学参数。根据NCT03608618与NCT04660929的最新结果,MCY-M11与CT-0508均表现出良好的可行性与安全性。在接受MCY-M11治疗的患者中,36.4%达到疾病稳定(SD);而CT-0508治疗组的疾病稳定率为28.6%。
初步研究显示,CT-0508 CAR-M疗法相较于传统CAR-T具有多重优势。首先,它具有多功能抗肿瘤活性。对肿瘤活检组织的RNA测序分析表明,CT-0508能够上调抗原呈递、适应性免疫及肿瘤微环境重塑相关基因的表达。肿瘤微环境及外周血中细胞毒性T细胞浸润的增加,证实了T细胞的有效激活。其次,CAR-M在输注后外周循环中的存留时间较短(≤48小时),这可能会降低因细胞长期存留所致的细胞因子释放综合征(CRS)风险。此外,该疗法无需在输注前进行淋巴细胞清除性预处理,从而避免了相关的免疫抑制、感染风险及血细胞减少等不良反应。最后,CT-0508的生物分布分析显示其对转移灶的治疗潜力,在肝转移(80%)和淋巴结转移(50%)灶中观察到病灶显著缩小。
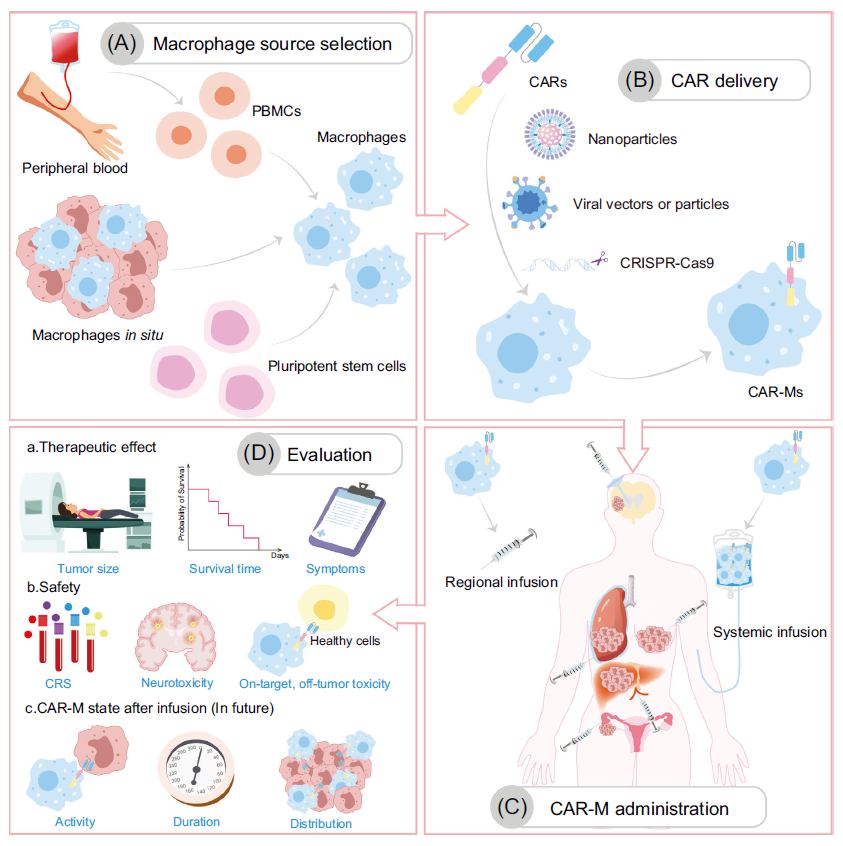
图3. CAR-M临床治疗路线图
表3. CAR-M临床试验进展
4. CAR-M联合治疗策略
研究表明,CAR-M疗法可与手术、化疗、CAR-T、免疫检查点抑制剂(ICI)及抗CD47疗法等联合应用,在多种肿瘤模型中展现出增强的抗肿瘤效果。能够直接杀伤肿瘤细胞的治疗方式(如化疗、放疗或靶向治疗)可诱导肿瘤细胞发生免疫原性死亡(ICD),并释放肿瘤相关抗原,从而增强CAR-M的吞噬功能、抗原提呈能力以及促炎细胞因子的分泌。此外,将CAR-M与其他免疫疗法联用,能够强化免疫细胞间的通讯与协作,从而引发更强大、更持久的抗肿瘤免疫应答。
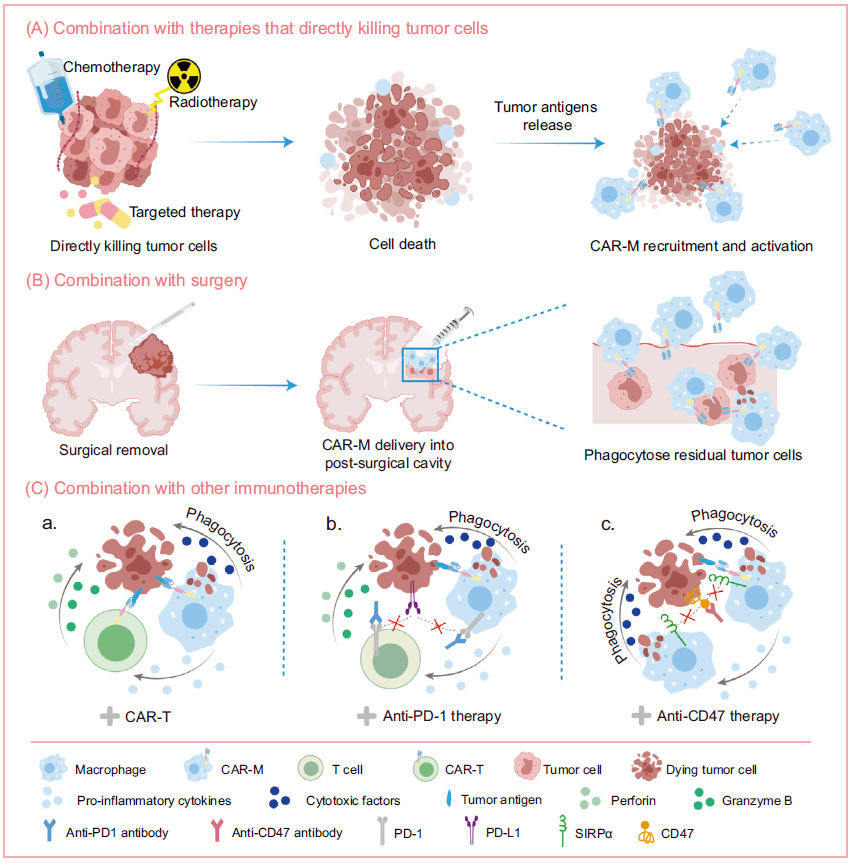
图4. CAR-M联合治疗策略
5. CAR-M未来发展趋势
与已相对成熟的CAR-T技术相比,当前CAR-M的技术优化仍处于早期发展阶段。目前已报道的CAR-M构建体多为第一代(仅包含单个介导吞噬作用的胞内信号域)或第二代(整合了可同时增强吞噬功能与促炎因子分泌的双重信号域)。CAR-M的核心优势在于其能够主动浸润至实体肿瘤内部,发挥吞噬肿瘤细胞、递呈抗原及重塑肿瘤微环境的多重抗肿瘤效应。然而,其疗效仍受到肿瘤抗原表达的异质性及免疫抑制性微环境的显著制约。为进一步提升其治疗潜力,有必要从CAR结构设计(如信号域优化)、细胞基因编辑(如增强持久性与抗耗竭能力)以及联合治疗策略等方面进行优化,重点提高CAR-M疗法的特异性、适应性、疗效及安全性。
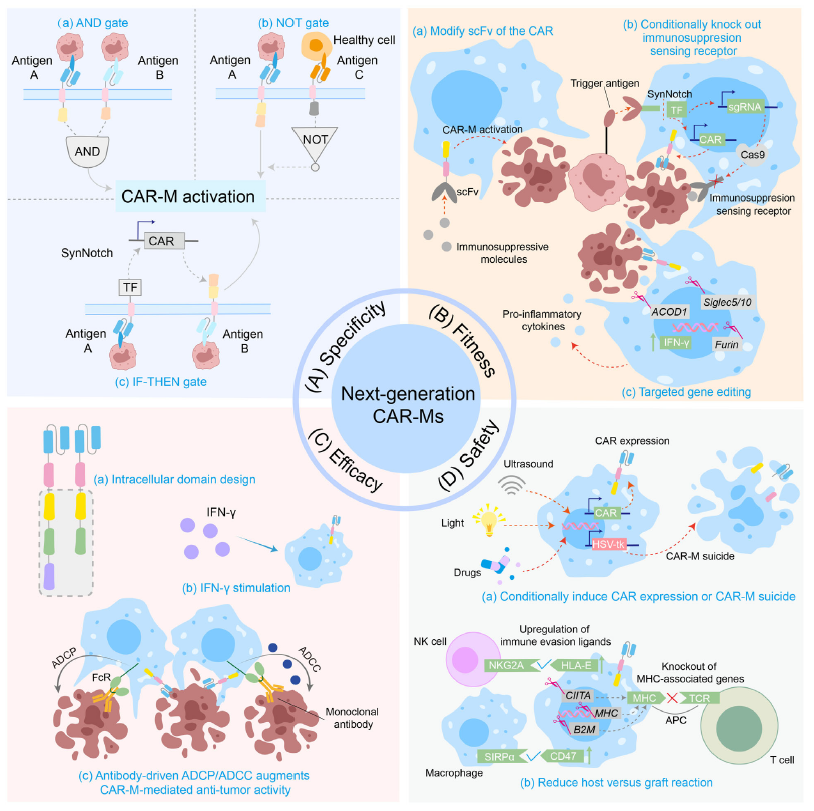
图5. 下一代CAR-M
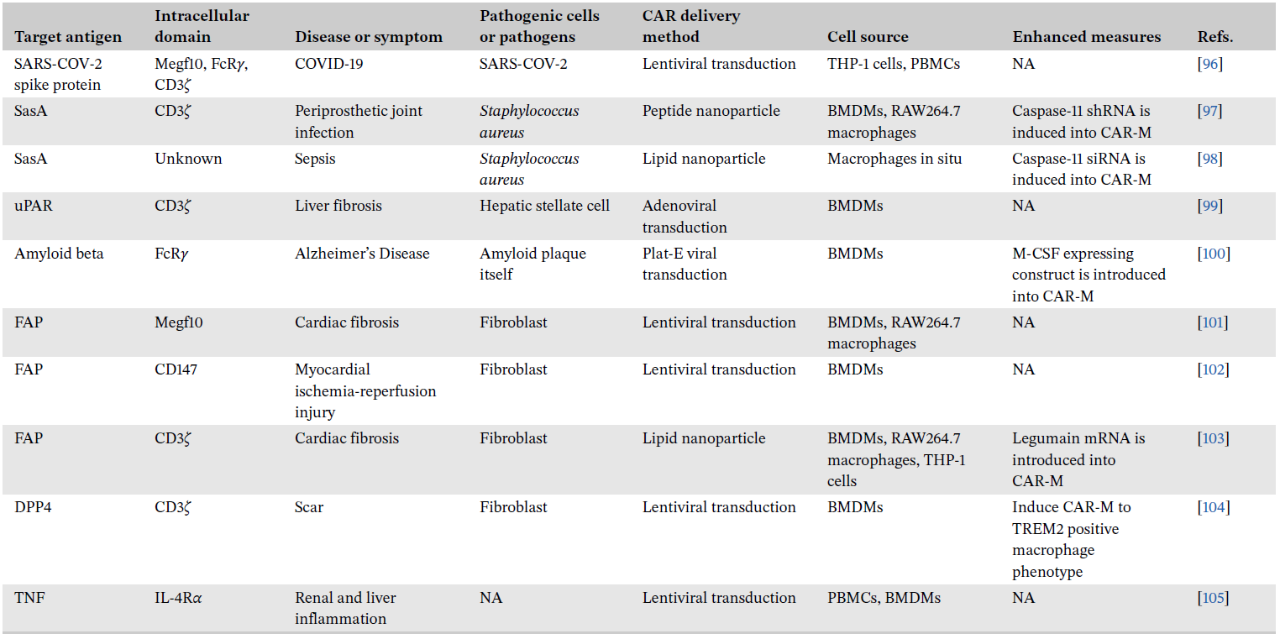
此外,CAR-M在非肿瘤性疾病领域也展现出广阔的应用前景。与恶性肿瘤相比,CAR-M在应对非肿瘤性疾病时面临的障碍相对较少。首先,非肿瘤性病变中的致病细胞通常增殖能力有限,疾病负荷较低,即使CAR-M未能完全清除靶细胞,仍可产生显著的治疗效果。其次,非肿瘤性疾病的相关抗原表达相对稳定,突变负荷较低。再者,非肿瘤环境中缺乏强效的免疫抑制性微环境,有利于CAR-M充分发挥其功能活性。目前,CAR-M疗法已在感染性疾病、组织纤维化、神经退行性疾病及慢性炎症性疾病等非肿瘤领域展现出治疗潜力。
表4. CAR-M在非肿瘤领域中的应用
总结
临床前与临床研究数据均证实,CAR-M 在肿瘤学及非肿瘤性疾病治疗中具有潜在疗效。尽管基因编辑技术和联合治疗策略的应用已在一定程度上提升了其安全性与有效性,且新一代 CAR-M 正逐步发展,但目前仍存在一些关键科学问题亟待阐明。例如输注后 CAR-M 的体内分布特征、可用于动态疗效监测与剂量优化的液体活检生物标志物的鉴定,以及如何利用 CAR-M 与免疫细胞间的相互作用塑造免疫刺激型肿瘤微环境。
新兴技术如时空组学、光谱追踪、多光子成像及放射性标记等,有望揭示 CAR-M 在体内的迁移轨迹、持久性及组织适应性。明确这些参数将有助于开发用于输注后监测和疗效预测的生物标志物。NCT04660929 研究数据显示,CAR-M 对 T 细胞具有双重作用(激活与耗竭),但其机制尚不明确。借助单细胞与空间组学分析,可进一步阐明 CAR-M 与免疫细胞之间的相互作用及其对肿瘤微环境的重塑机制,从而为下一代 CAR 设计或联合治疗策略提供理论依据。此外,人工智能驱动的肿瘤特异性发病机制模型将有助于优化 CAR-M 的设计与患者分组;同时,合成免疫学的进展也将推动 CAR-M 的大规模生产实现。
撰稿:原文作者
撰稿:原文作者
编辑:林志祥; 审核:阮继
来源:Cancer Communications