新型抗肿瘤药物超说明书用药管理专家共识
浙江省医院协会药事管理专业委员会,浙江省医院药事管理质控中心,
上海市医院协会临床药事管理专业委员会,江苏省医院协会医院药事
管理专业委员会,安徽省医院协会药事管理专业委员会

【摘要】为提升用药安全性和合理性,组织长三角地区药学、临床医学、行政管理和循证医学专家,基于循证医学证据,采用德尔菲法通过多轮专家咨询和论证形成共识,构建了包含分级管理流程和区域信息共享平台的新型抗肿瘤药物超说明书用药管理体系。通过明确该类药物超说明书用药申请、审批、备案及动态调整等环节,实现规范化管理;依托区域信息共享平台统一进行该类药物超说明书循证医学证据的收集和审核,推动各级医疗机构实现同质化管理。期望通过建立分级管理流程和信息共享平台助力各级医疗机构规范新型抗肿瘤药物超说明书用药管理。
【关键词】抗肿瘤药;超说明书用药管理;信息共享平台;专家共识
引用本文:浙江省医院协会药事管理专业委员会,浙江省医院药事管理质控中心,上海市医院协会临床药事管理专业委员会, 等. 新型抗肿瘤药物超说明书用药管理专家共识[J]. 浙江大学学报(医学版), 2025, 54 (5): 567-572.
随着新型抗肿瘤药物的快速研发和临床试验的推进,药品监督管理部门对该类药物采取了快速通道审批,大量新型抗肿瘤药物快速获批上市且适用范围不断更新。药品说明书是药物临床应用的法定依据,但其更新存在滞后性,这一问题在新型抗肿瘤药物领域尤为突出,使得超说明书用药较为普遍。中山大学肿瘤防治中心的研究数据显示,程序性死亡受体1抑制剂等新型抗肿瘤药物超说明书用药比例超过60%[1],可能带来用药安全风险。目前各级医疗机构对新型抗肿瘤药物超说明书用药管理缺乏统一的规范和管理路径,不利于该类药物的合理应用。因此,亟待制订新型抗肿瘤药物超说明书用药管理的专家共识供医疗机构参考使用。
为贯彻落实《中华人民共和国医师法》[2]第二十九条、《抗肿瘤药物临床应用管理办法(试行)》(国卫医函〔2020〕487号)[3]及《新型抗肿瘤药物临床应用指导原则(2024年版)》(国卫办医政函〔2025〕2号)[4]等文件要求,规范医疗机构新型抗肿瘤药物超说明书用药管理,推动管理同质化及合理化,浙江省医院协会药事管理专业委员会联合浙江省医院药事管理质控中心在前期调研的基础上组织长三角地区药学、临床医学、行政管理和循证医学专家,通过德尔菲法开展多轮调研和论证,最终形成《新型抗肿瘤药物超说明书用药管理专家共识》(以下简称共识)。共识旨在为医疗机构提供新型抗肿瘤药物超说明书用药管理规范及目录制订依据,优化管理流程,以适应临床快速发展的用药需求,提升用药合理性和安全性。
1 共识的制订和适用范围
本共识由浙江省医院协会药事管理专业委员会和浙江省医院药事管理质控中心牵头,联合上海市医院协会临床药事管理专业委员会、江苏省医院协会医院药事管理专业委员会及安徽省医院协会药事管理专业委员会共同制订。共识适用于各级医疗机构开展新型抗肿瘤药物超说明书用药的规范化管理,适用范围不包括临床研究药物的管理。
2 新型抗肿瘤药物超说明书用药的规范化管理
2.1 相关定义
本共识所称新型抗肿瘤药物包括国内已上市的小分子靶向药物、大分子单克隆抗体类药物(含抗体药物偶联物)及双克隆抗体类药物,其具体范围参照《新型抗肿瘤药物临床应用指导原则(2024年版)》[4]。超说明书用药指未在国家药品监督管理部门批准的药品说明书记载范围内的用药方式,包括超适应证、超剂量、超疗程用药、改变用药途径、改变适用人群等[5-6]。
2.2 超说明书用药前提
在尚无更优治疗方案的情况下,若医生确需采用新型抗肿瘤药物超说明书用药,必须全面评估可能发生的不良反应或不良事件、禁忌证及注意事项,审慎权衡患者获益和风险,确保该方案是最符合患者当前利益的选择。必须始终以保障患者最大利益为根本原则,严禁以试验、研究或医务人员自身利益为目的的超说明书用药。
2.3 超说明书用药规范化管理流程
新型抗肿瘤药物超说明书用药规范化管理流程主要包括三个核心环节:首先,基于循证医学证据等级实施分级管理,针对不同级别建立差异化审批流程,审批通过后纳入机构药品目录;然后,建立医师处方权限授权管理和药师智能化审方规则体系;最后,形成动态调整机制,包括超说明书用药的动态退出和用药目录的及时修订,从而构建完整的闭环管理体系。
2.3.1 分级管理实施依据
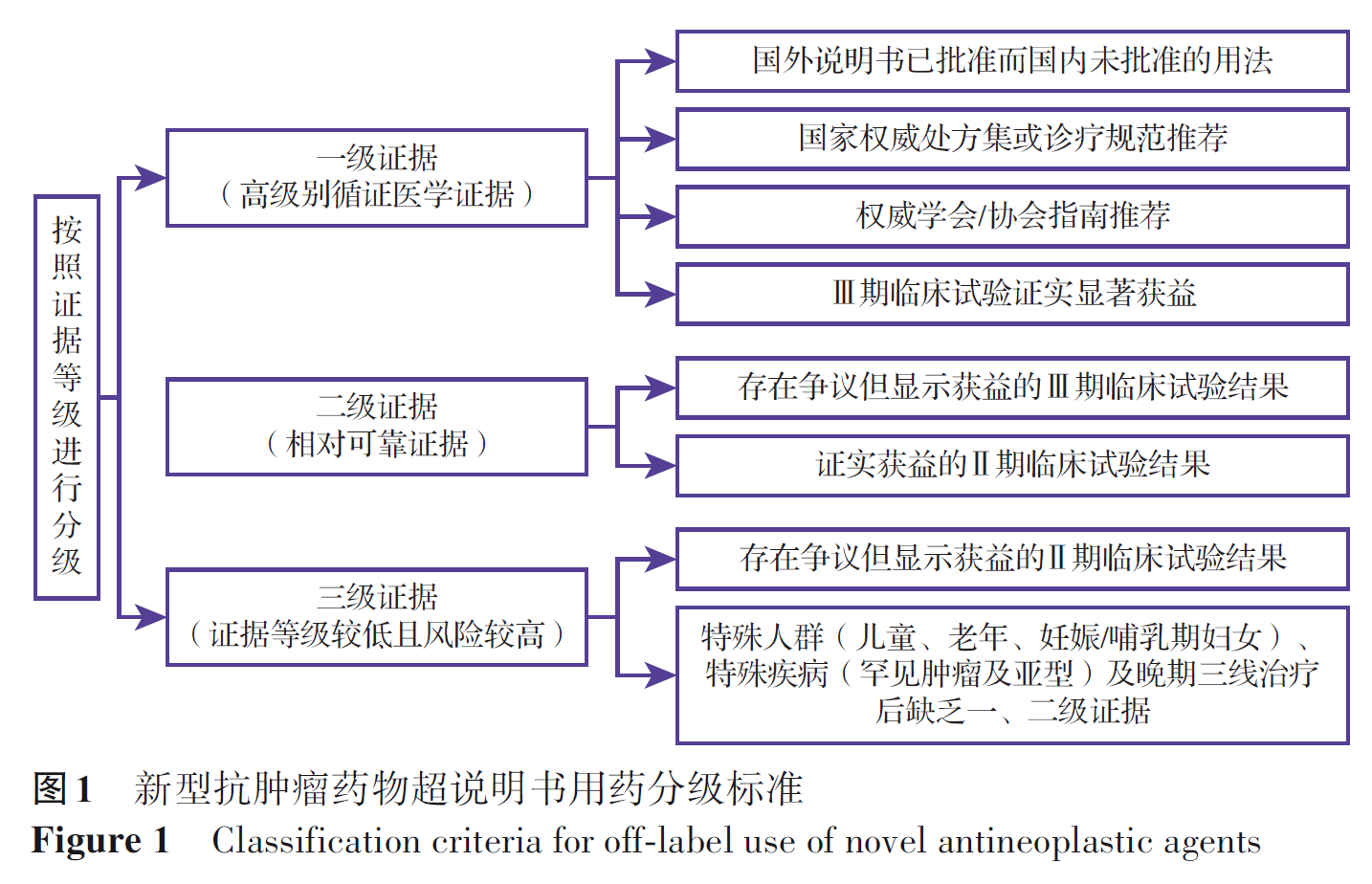
新型抗肿瘤药物超说明书用药须进行充分的循证医学论证,根据证据等级分为三级:①一级证据:具有高级别循证医学证据,包括国外说明书已批准而国内未批准的用法、国家权威处方集或诊疗规范推荐、权威学会/协会指南推荐和Ⅲ期临床试验证实显著获益;②二级证据:具有相对可靠证据,包括存在争议但显示获益的Ⅲ期临床试验结果和证实获益的Ⅱ期临床试验结果;③三级证据:证据等级较低且风险较高,包括存在争议但显示获益的Ⅱ期临床试验结果,特殊人群(儿童、老年、妊娠/哺乳期妇女)、特殊疾病(罕见肿瘤及亚型)及晚期三线治疗后缺乏一、二级证据的情况。具体分级标准见图1。
2.3.2 分级管理差异化审批流程
医疗机构应建立新型抗肿瘤药物超说明书用药分级管理制度:①一级管理(一级证据):临床医生提交申请,科主任审批后提交药学部初审,通过后由医务部批准并提交药事管理与药物治疗学委员会备案后准予使用;②二级管理(二、三级证据):临床医生提交申请,科主任审批后提交药学部初审,初审通过后提交药事管理与药物治疗学委员会联合医学伦理委员会共同审核,再经医务部批准备案后准予使用。在患者病情危重等紧急情况下经科室讨论后可先使用未备案药物,但须在用药后24 h内补交申请。具体流程见图2。
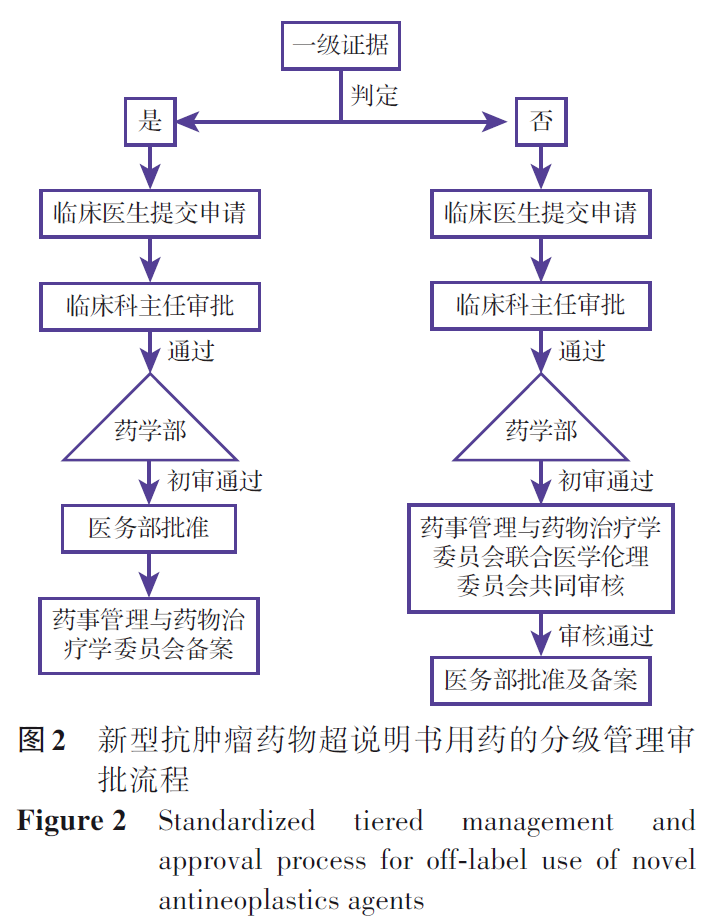
申报材料应包括以下五项内容:新型抗肿瘤药物超说明书用药申报表(附件1)、支持超说明书用药的循证医学证据材料、详细的用药方案(包括剂量、疗程及给药方式)、患者知情同意书(附件2)以及用药风险防控预案。
经审批备案的超说明书用药方案应及时列入本医疗机构超说明书用药目录并予以公示,后续相同用药情形可免于重复申报审批。
2.3.3 医师处方权限管理
申请新型抗肿瘤药物超说明书用药的医师必须取得相应处方权限(依据国家及本省相关规定)。原则上应由患者的主管医生提出申请,其中三级证据的超说明书用药须由相关专业高级职称医师开具处方或医嘱。
2.3.4 药师智能化审方规则体系建立
执行新型抗肿瘤药物超说明书用药处方审核的药师须具备相应抗肿瘤药物审方资质。建议采用智能化审方系统,预设超说明书用药审核规则,原则上仅限纳入目录的方案可通过审核。目录内超说明书给药方案视同常规用药管理。遇紧急情况需临时使用目录外方案时,须经主管医生和科主任双签审批方可开放单次使用权限。
2.3.5 动态退出机制构建
医疗机构应建立超说明书用药动态退出机制,当出现以下任一情形时,临床科室或药学部应及时向医院药事管理与药物治疗学委员会提交退出申请:①该用法已列入国内说明书;②最新循证医学证据显示该用法无效或风险大于获益;③监测到严重不良反应。药事管理与药物治疗学委员会审核通过申请后,管理部门应立即将该方案从超说明书用药目录中撤销。
2.3.6 动态调整目录
各医疗机构应基于信息共享平台提供的最新循证医学证据,结合药品说明书更新内容及本机构审批和退出结果,动态更新本机构新型抗肿瘤药物超说明书用药目录,并及时在院内公示,以确保临床用药信息实时更新。
2.4 不良反应报告及救治
研究表明,缺乏循证医学证据的超说明书用药可能会显著增加药物不良反应发生率[7-8]。鉴于新型抗肿瘤药物上市后5年内仍属不良反应监测期,一旦发生不良反应,医疗机构应立即实施救治并按规定及时上报。
2.5 患者知情同意
医疗机构必须切实保障患者的知情同意权和自主选择权。在实施新型抗肿瘤药物超说明书用药前,医务人员应向患者详细说明用药依据、治疗方案、预期疗效、费用、潜在风险及注意事项等内容,并获得其书面知情同意书。特殊情况下无法直接告知患者的,须向其法定监护人或家属充分告知并获得书面同意。同时,医务人员应在患者病历中完整记录超说明书用药的临床依据和告知过程。
2.6 质量控制和风险防范
医疗机构应建立超说明书用药定期评价机制,通过处方点评、用药监测等手段系统评估新型抗肿瘤药物超说明书用药的安全性、有效性和经济性,并及时干预不合理用药行为。针对三级证据且临床需求有限的超说明书用药,应重点管控,要求申请科室必须制订完善的风险防控措施和应急预案。
3 新型抗肿瘤药物超说明书用药信息共享平台构建
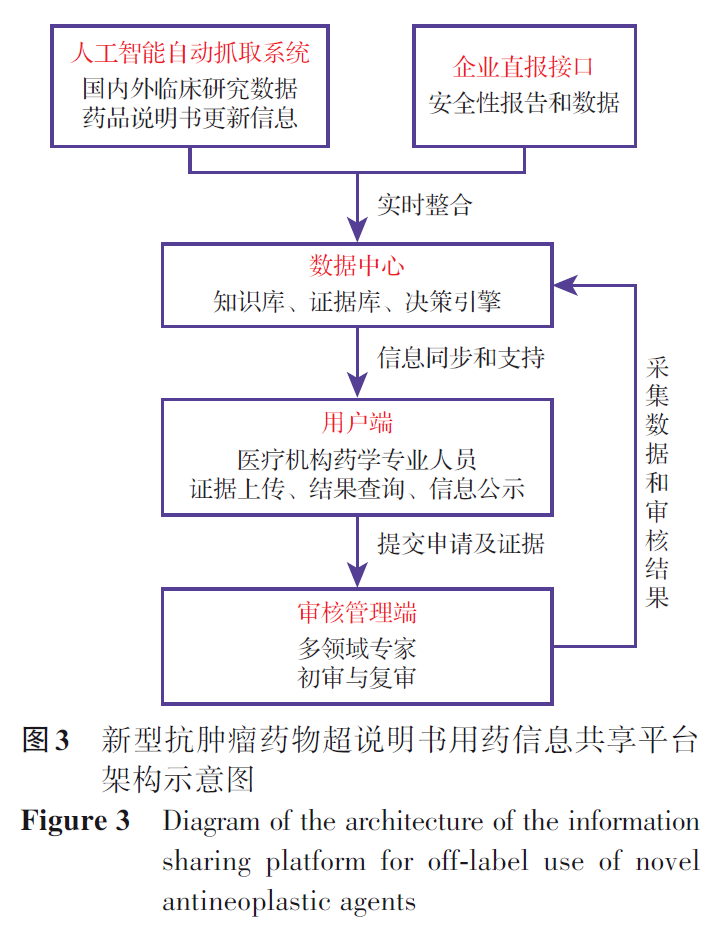
为促进新型抗肿瘤药物超说明书用药的规范化和同质化管理,适应肿瘤治疗领域的快速发展,试点建立了新型抗肿瘤药物超说明书用药信息共享平台。该平台采用“专业上传-专家审核”的运作模式,由医疗机构药学专业人员提交超说明书用药申请及相关循证医学证据,随后经临床医学、药学、伦理等领域专家进行两级审核(初审和复审),审核通过后方可发布。平台结构主要包括用户端、审核管理端和数据中心三大模块,支持证据上传、在线审核、结果查询和信息公示等功能(图3)。平台融合了人工智能自动抓取和企业直报机制,能够实时整合国内外最新临床研究数据、药品说明书更新信息及企业安全性报告,显著提升信息的准确性和时效性。通过该平台可实现区域内循证医学资源的高效共享,避免重复检索和资源浪费,并加强超说明书用药行为的全过程监管,为各级医疗机构提供权威、统一的决策支持,从而提升整体用药管理质量和效率。
4 结 语
随着我国药物研发能力的显著提升,新型抗肿瘤药物领域快速发展,不仅进口原研药持续引进,国产创新药也取得突破性进展。针对同一靶点的药物选择日益增多,但部分用药方案尚缺乏高级别循证医学证据支持,加之药品说明书的更新存在滞后性,致使临床上超说明书用药现象日益普遍。这一现状凸显了加强新型抗肿瘤药物超说明书用药规范化管理的紧迫性。本共识的制订旨在为临床实践提供科学参考,助力提升我国肿瘤治疗的规范化水平。
共识基于对新型抗肿瘤药物超说明书用药现状的全面调研,汇集了浙沪苏皖四省市药学、临床医学、行政管理和循证医学等领域专家的集体智慧。经过多轮专题会议(包括会前会、启动会和专家讨论会)深入研讨,最终形成本共识文件。本共识主要从两个层面推进规范化管理:一是建立标准化的超说明书用药管理流程,二是构建区域用药信息共享平台,旨在实现新型抗肿瘤药物超说明书用药的同质化管理,形成科学闭环,切实保障患者用药安全。鉴于编写时限,本共识可能存在未尽完善之处,敬请各界专家提出宝贵意见,以便后续修订。
本共识制订专家组成
专家组组长
卢晓阳 浙江大学医学院附属第一医院
郭 澄 上海交通大学医学院附属第六医院
缪丽燕 苏州大学附属第一医院
姜 玲 中国科学技术大学附属第一医院
专家组成员(按照姓氏音序排列)
曹文明 浙江省肿瘤医院
陈瑞杰 温州医科大学附属第二医院
戴海斌 浙江大学医学院附属第二医院
方 罗 浙江省肿瘤医院
方维佳 浙江大学医学院附属第一医院
管 燕 浙江大学医学院附属邵逸夫医院
郭 澄 上海市第六人民医院
黄 萍 浙江省人民医院
姜 玲 中国科学技术大学附属第一医院
李晴宇 杭州市第一人民医院
林观样 温州医科大学附属第一医院
林能明 杭州市第一人民医院
柳 琳 浙江大学医学院附属第一医院
卢丽琴 浙江省人民医院
卢晓阳 浙江大学医学院附属第一医院
缪丽燕 苏州大学附属第一医院
饶跃峰 浙江大学医学院附属第一医院
单建贞 浙江大学医学院附属第一医院
邵 华 东南大学附属中大医院
沈甫明 上海市第十人民医院
史天陆 中国科学技术大学附属第一医院
谭亚敏 浙江省肿瘤医院
佟红艳 浙江大学医学院附属第一医院
王 斌 复旦大学附属华山医院
王 刚 杭州市第一人民医院
王玮琴 浙江省中医院
王 娴 浙江大学医学院附属邵逸夫医院
王永庆 江苏省人民医院
王 卓 海军军医大学第一附属医院
夏 泉 安徽医科大学第一附属医院
谢升阳 浙江省中医院
许东航 浙江大学医学院附属第二医院
杨 柳 浙江省人民医院
叶子奇 浙江大学医学院附属第一医院
余新民 浙江省肿瘤医院
袁 瑛 浙江大学医学院附属第二医院
张卫平 浙江中医药大学附属第三医院
张晓琛 浙江大学医学院附属第一医院
郑小卫 浙江省人民医院
周 华 宁波市医疗中心李惠利医院
朱建国 苏州大学附属第一医院
执笔者
叶子奇 郑小卫
本文附加文件见电子版

参考文献
References
[1] 丘九望, 卢翠婷, 曾晓华, 等. 179例日间化疗中心患者纳武利尤单抗应用分析[J]. 中国医院用药评价与分析, 2020, 20(5): 599-602.QIU Jiuwang, LU Cuiting, ZENG Xiaohua, et al.Analysis of application of nivolumab in 179 patients in day chemotherapy center[J]. Evaluation and Analysisof Drug-Use in Hospitals of China, 2020, 20(5): 599-602. (in Chinese)
[2] 中华人民共和国医师法[EB/OL]. (2021-08-20)[2022-04-18]. http://www.gov.cn/xinwen/2021-08/20/content_5632496.htm.Law on doctors of the People’s Republic of China[EB/OL]. (2021-08-20)[2022-04-18]. http://www.gov.cn/xinwen/2021-08/20/content_5632496.htm. (in Chinese)
[3] 中华人民共和国国家卫生健康委. 国家卫生健康委关于印发抗肿瘤药物临床应用管理办法(试行)的通知[EB/OL]. (2020-12-28) [2022-04-18]. https://www.nhc.gov.cn/yzygj/c100068/202012/02cc3fdaca5c46519b24d677b56bb499.shtml. National Health Commission of the People’s Republic of China. Notice of the National Health Commission on issuing the Management Measures for Clinical Application of Antineoplastic agents (Trial)[EB/OL]. (2020-12-28)[2022-04-18]. https://www. nhc. gov. cn/yzygj/c100068/202012/02cc3fdaca5c46519b24d677b56bb499.shtml. (inChinese)
[4] 中华人民共和国国家卫生健康委办公厅. 国家卫生健康委办公厅关于印发新型抗肿瘤药物临床应用指导原则(2024 年版)的通知[EB/OL]. (2024-12-31)[2025-01-07]. https://www. nhc. gov. cn/wjw/c100378/202501/decc6754e67640288523d5eb5f5d0f84.shtml.General Office of the National Health Commission of the People’s Republic of China. Notice of the General Office of the National Health Commission on issuing the Guidelines for the Clinical Application of Novel Antineoplastic agents (2024 Edition) [EB/OL]. (2024-12-31) [2025-01-07]. https://www. nhc. gov. cn/wjw/c100378/202501/decc6754e67640288523d5eb5f5d0f84.shtml. (in Chinese)
[5] 任晓旭. 超说明书用药风险及防范[J]. 中国小儿急救医学, 2018, 25(1): 4-7.REN Xiaoxu. Risk and prevention of off-label drug uses[J]. Chinese Pediatric Emergency Medicine, 2018,25(1): 4-7. (in Chinese)
[6] 广东省药学会. 超药品说明书用药中患者知情同意权的保护专家共识[J]. 今日药学, 2019, 29(6):361-367. Guangdong Pharmaceutical Association. Expert consensus on the protection of patients’ right to informedconsent in off-label medication[J]. Pharmacy Today,2019, 29(6): 361-367. (in Chinese)
[7] EGUALE T, BUCKERIDGE D L, VERMA A, et al. Association of off-label drug use and adverse drug events in an adult population[J]. JAMA Intern Med, 2016, 176(1): 55-63.
[8] HAN N, OH J M, KIM I W. Adverse events related to off-label drugs using spontaneous adverse event reporting systems[J]. Ther Clin Risk Manag, 2021, 17: 877-887.
来源:浙江大学学报(医学版)