前言
食管癌是我国高发且预后较差的消化道恶性肿瘤,每年新发病例约占全球半数。约70%患者初诊时已属局部晚期,传统同步放化疗虽为标准方案,但以顺铂为基础的方案毒副作用显著,约30%患者因无法耐受而影响疗效。近年来,“化疗联合免疫治疗”模式成为新标准。化疗通过快速降低肿瘤负荷、释放抗原,为免疫治疗奠定基础,二者协同增效。在这一模式下,化疗药物的选择尤为关键——需兼顾疗效与安全性。
洛铂作为第三代铂类药物,在保持抗肿瘤活性的同时显著降低胃肠道、肾及神经毒性,为化免联合的持续应用提供保障。本文分享一例由徐州医科大学附属医院辛勇教授带来的局部晚期食管鳞癌病例,旨在深入探讨洛铂在化免联合治疗中的临床价值,为局部晚期食管癌的治疗优化提供参考。
专家简介

辛勇 教授
徐州医科大学附属医院
肿瘤学博士、副教授、硕士研究生导师
江苏省“六大高峰人才”培养对象
江苏省医师协会放射肿瘤治疗医师分会委员
江苏省医学会肿瘤放射治疗学分会青年委员
江苏省医学会肿瘤放射治疗学分会放射物理学组委员
江苏省抗癌协会鼻咽癌分会青年委员
江苏省神经内分泌肿瘤诊治中心淮海分中心委员
徐州市医师协会生物医学工程分会副主委
徐州市抗癌协会中青年专业委员会副秘书长
徐州市抗癌协会免疫治疗专业委员会常务委员
徐州市肿瘤防治专家库肿瘤放疗专家成员
徐州市核学会肿瘤放疗专业委员会常委
徐州市核学会第五届理事会理事
徐州市抗癌协会肿瘤内分泌专业委员会常务委员
徐州市免疫学会肿瘤放射与免疫专业委员会常务委员
徐州市核学会肿瘤放疗专业委员会常委
徐州市抗癌协会乳腺癌委员会常委
《徐州医科大学学报》青年编委
获得徐州市科技进步奖一等奖1项、江苏省卫生厅新技术引进一等奖1项
以第一或通讯作者在SCI收录期刊发表论著20余篇、最高影响因子41.4分
主要参与国家自然科学基金课题3项、指导7名研究生获得省研究生创新工程项目
基本信息
患者男性,59岁,因“进食哽咽”就诊。
初诊病史
2025-01-22:患者行胃镜及病理检查确诊为食管鳞状细胞癌,CT提示病变位于胸中下段,伴纵隔、左肺门及胃小弯旁多发淋巴结转移,临床分期为cT4N2M0,属于局晚期食管癌。
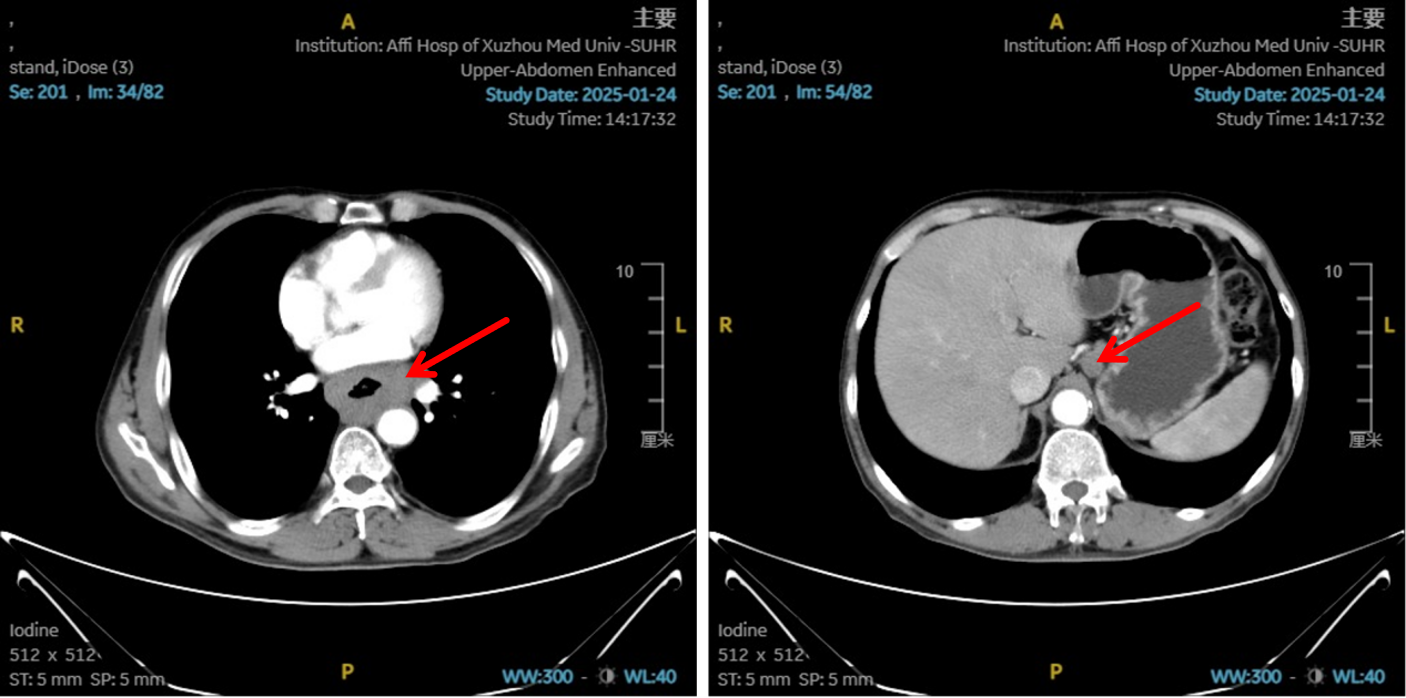
图1:初治影像学 [图左:食管胸中下段管壁增厚,强化不均,较厚处管壁约17mm,边缘模糊,病灶局部与邻近大血管、气管壁分界不清。图右:纵隔内(3P、4、7)、左肺门及胃小弯旁示多发增大淋巴结影,部分融合,强化不均,较大者大小约18mm×15mm。]
治疗经过
1. 诱导治疗(第1-2周期):
方案:紫杉醇聚合物胶束300mg+洛铂40mg+重组人血管内皮抑制素210mg。通过强效化疗联合抗血管药物,快速降低肿瘤负荷,逆转免疫抑制的微环境,为后续免疫治疗“铺路”。
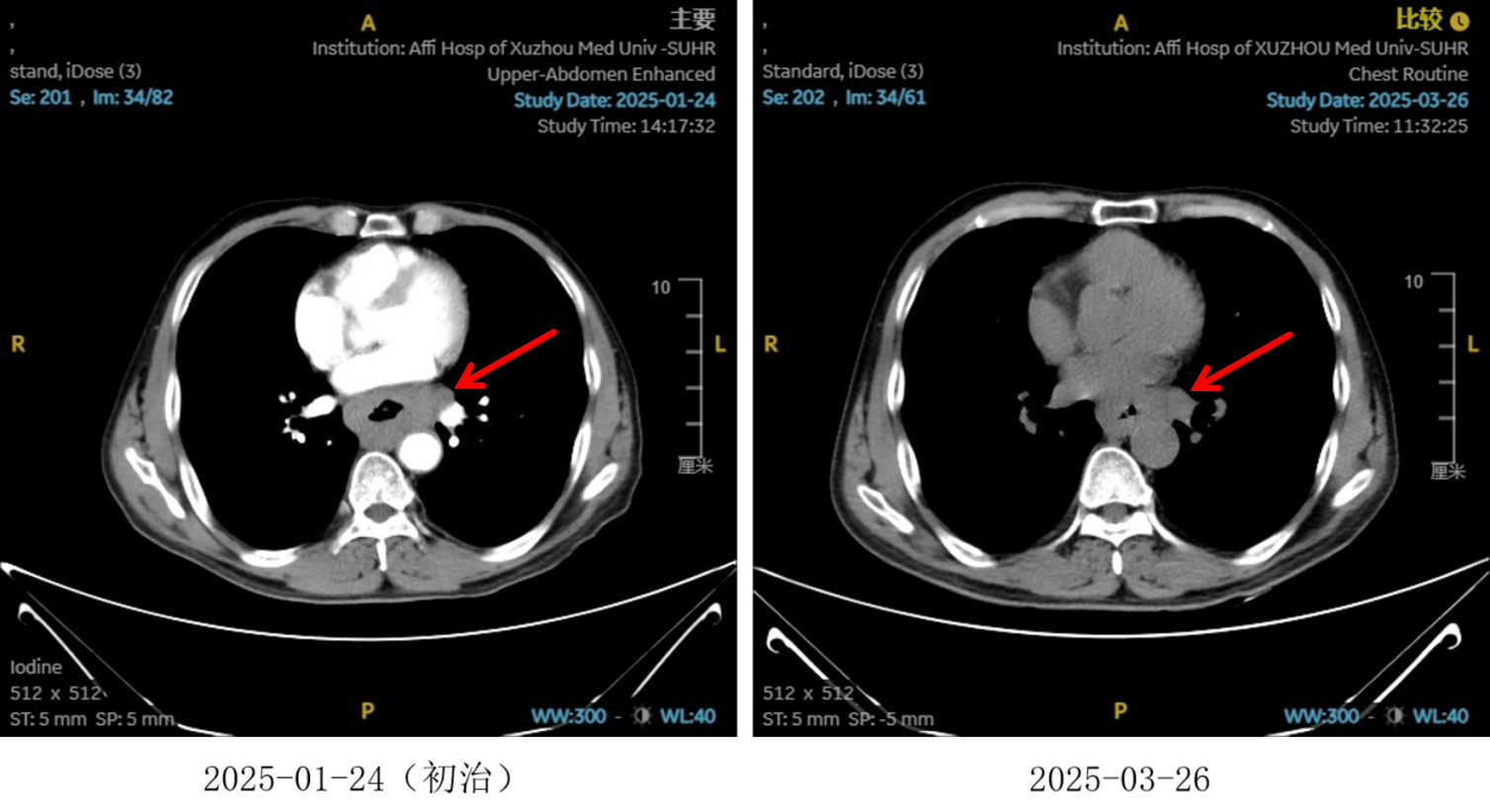
图2:2周期化疗联合抗血管治疗后食管癌病灶对比
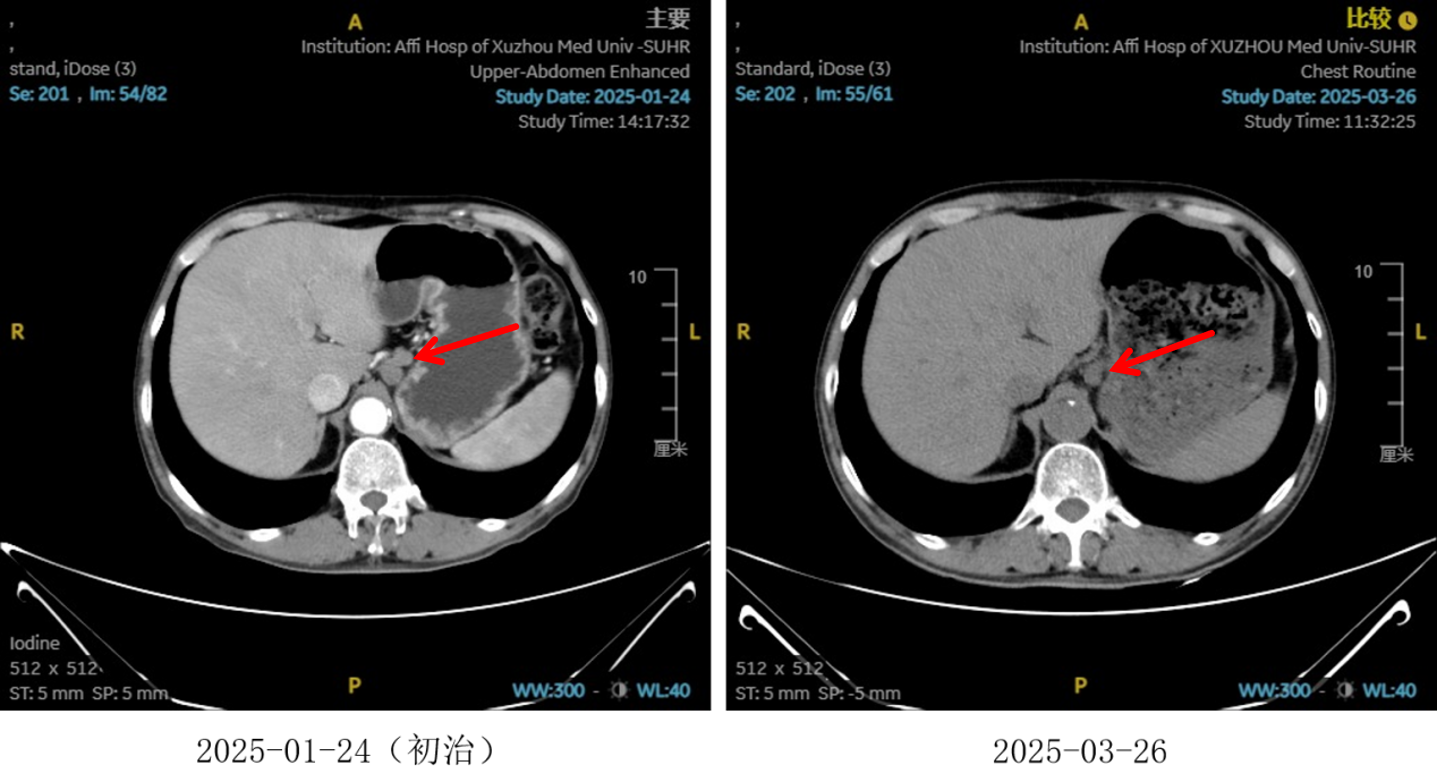
图3:2 周期化疗联合抗血管治疗后淋巴结对比
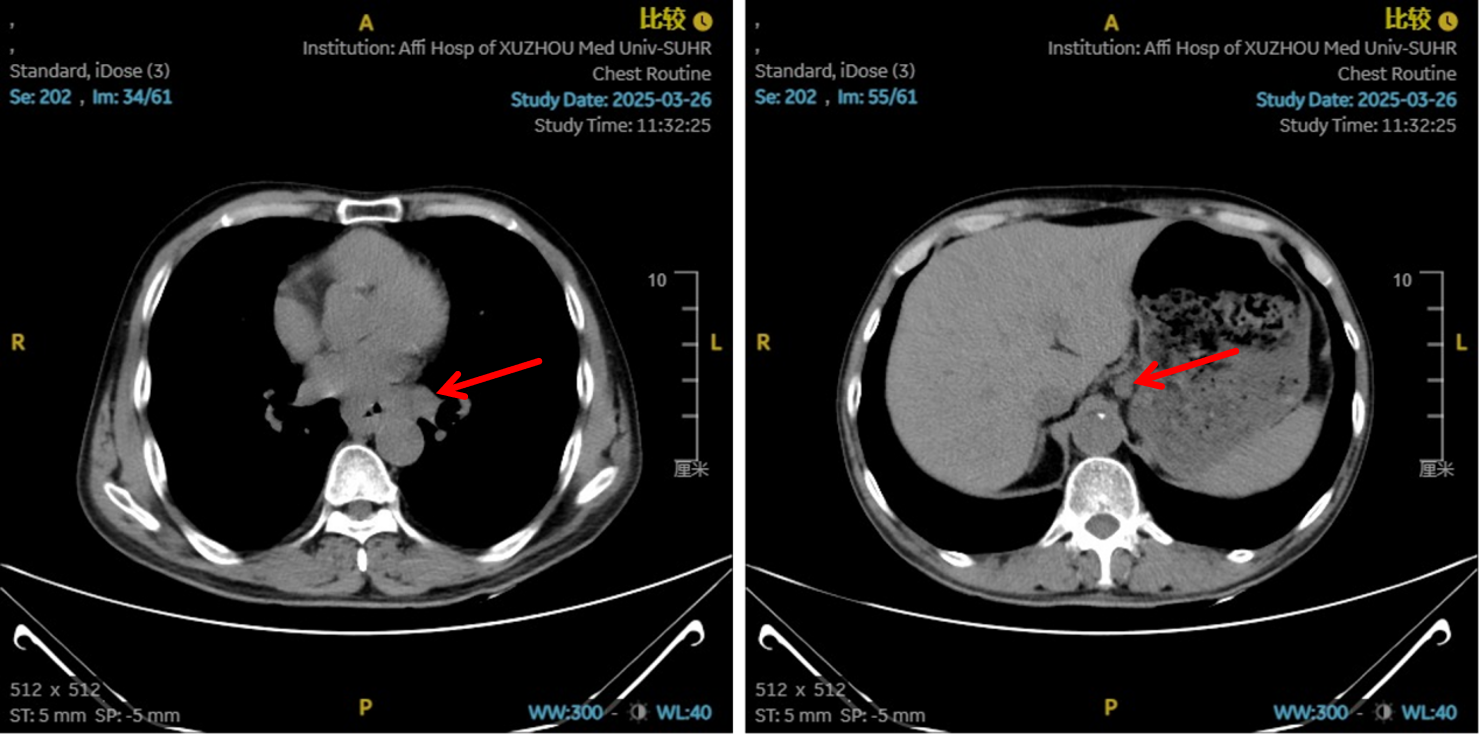
图4:2周期治疗后影像学 [图左:“食管Ca化疗后”,食管胸中下段管壁增厚,较厚处管壁约15mm,边缘模糊,病灶局部与邻近大血管、气管壁分界不清。图右:纵隔内(3P、4、7)、左肺门及胃小弯旁示多发稍大、增大淋巴结影,部分融合,较大者大小约16mmx13mm。]
2. 巩固与协同治疗(第3-6周期):
方案:在原有方案基础上联合PD-1抑制剂(紫杉醇聚合物胶束300mg+洛铂40mg+重组人血管内皮抑制素210mg+信迪利单抗200mg)。在化疗造成肿瘤细胞大量死亡、释放抗原的同时,联合PD-1抑制剂,解除T细胞抑制,激活全身性、长效的抗肿瘤免疫应答。
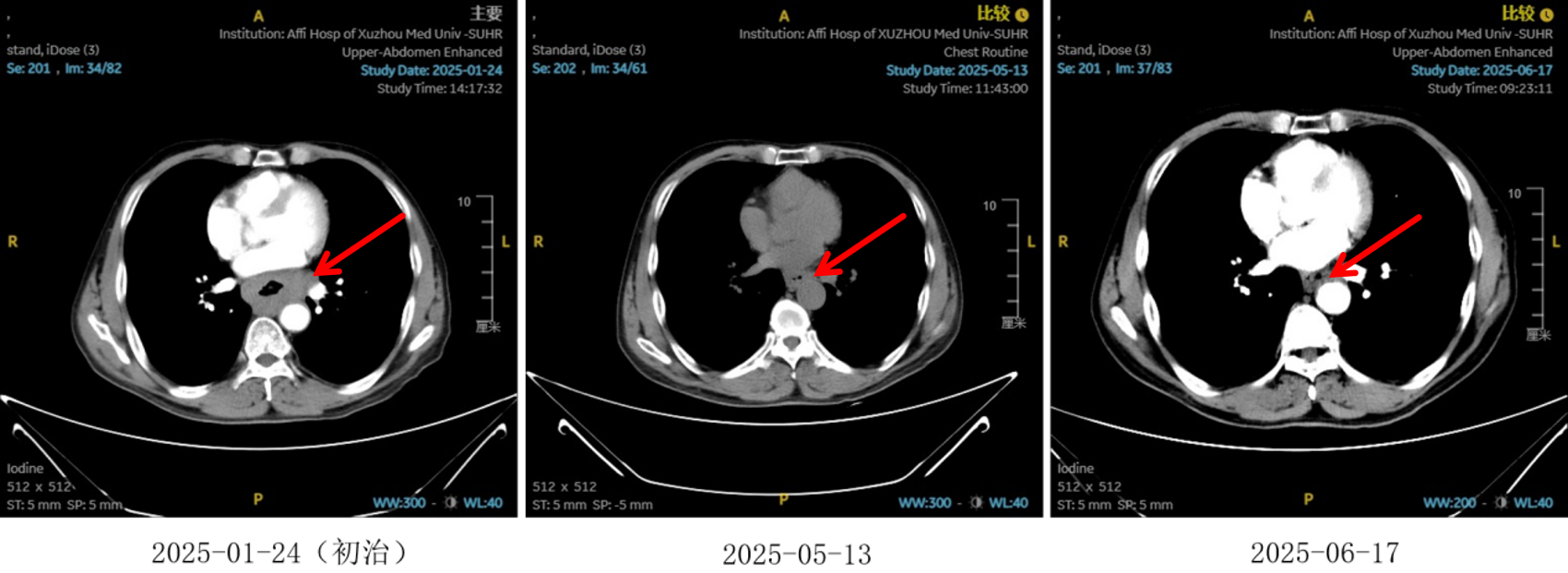
图5:4、6周期化免靶后食管癌病灶对比
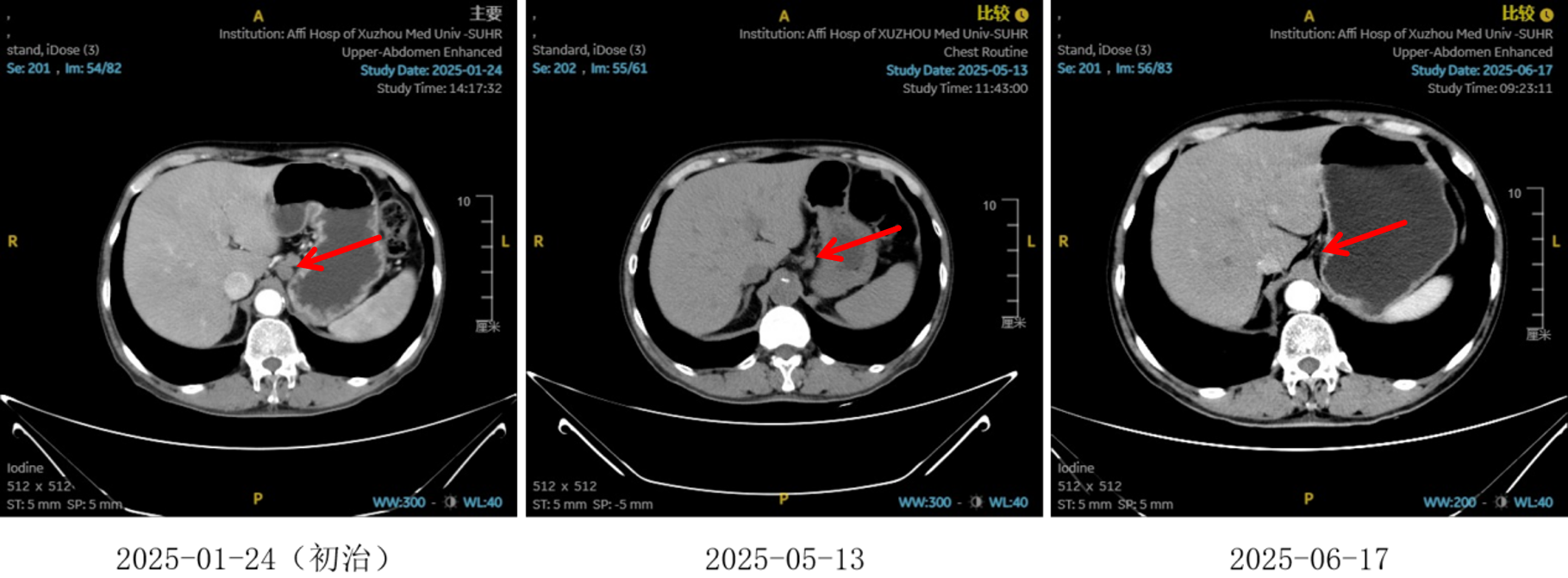
图6:4、6周期化免靶后淋巴结对比
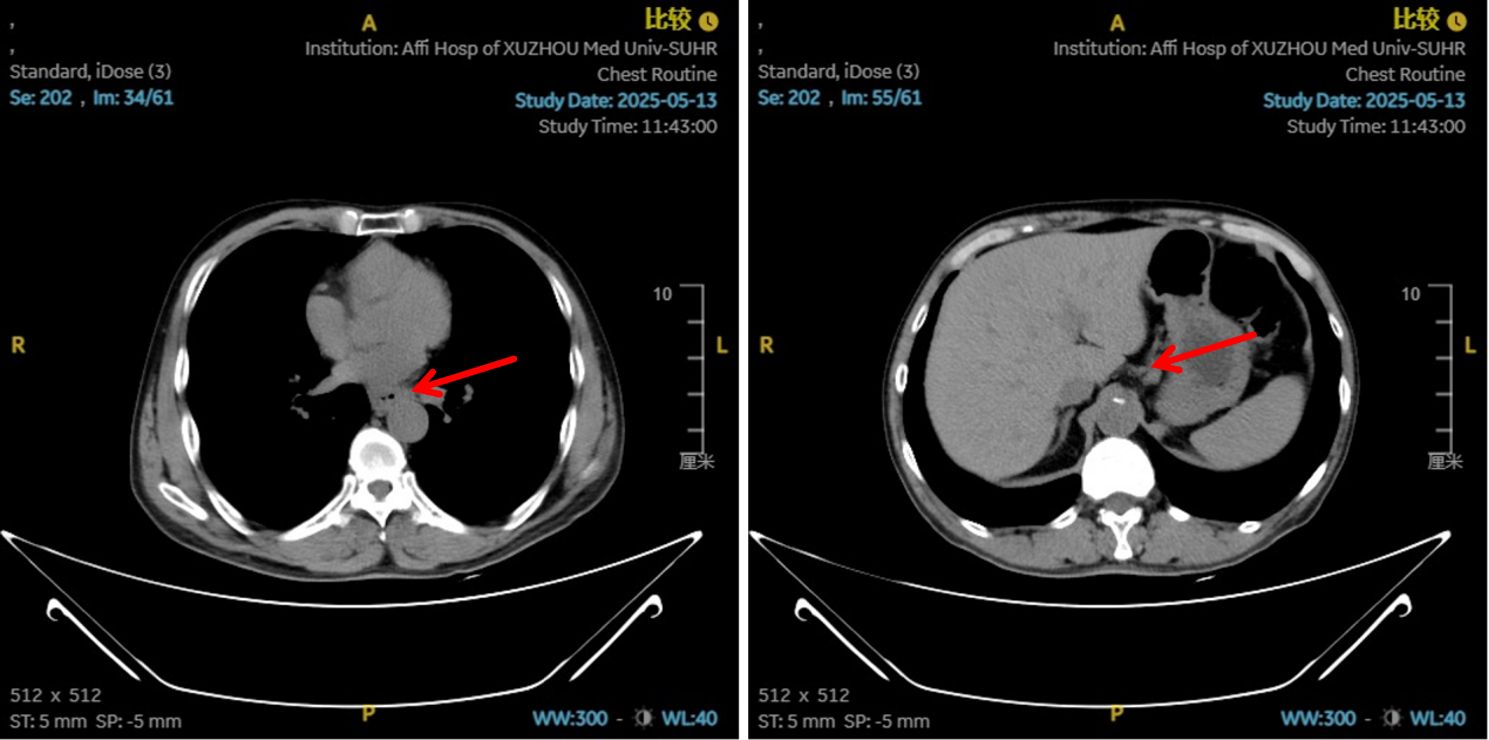
图7:4周期治疗后影像学 [图左:“食管Ca化疗后”,食管胸中下段管壁增厚,较厚处管壁约12mm,边缘模糊,病灶局部与邻近大血管、气管壁分界不清。图右:纵隔内(3P、4、7)、左肺门示稍大淋巴结影。]
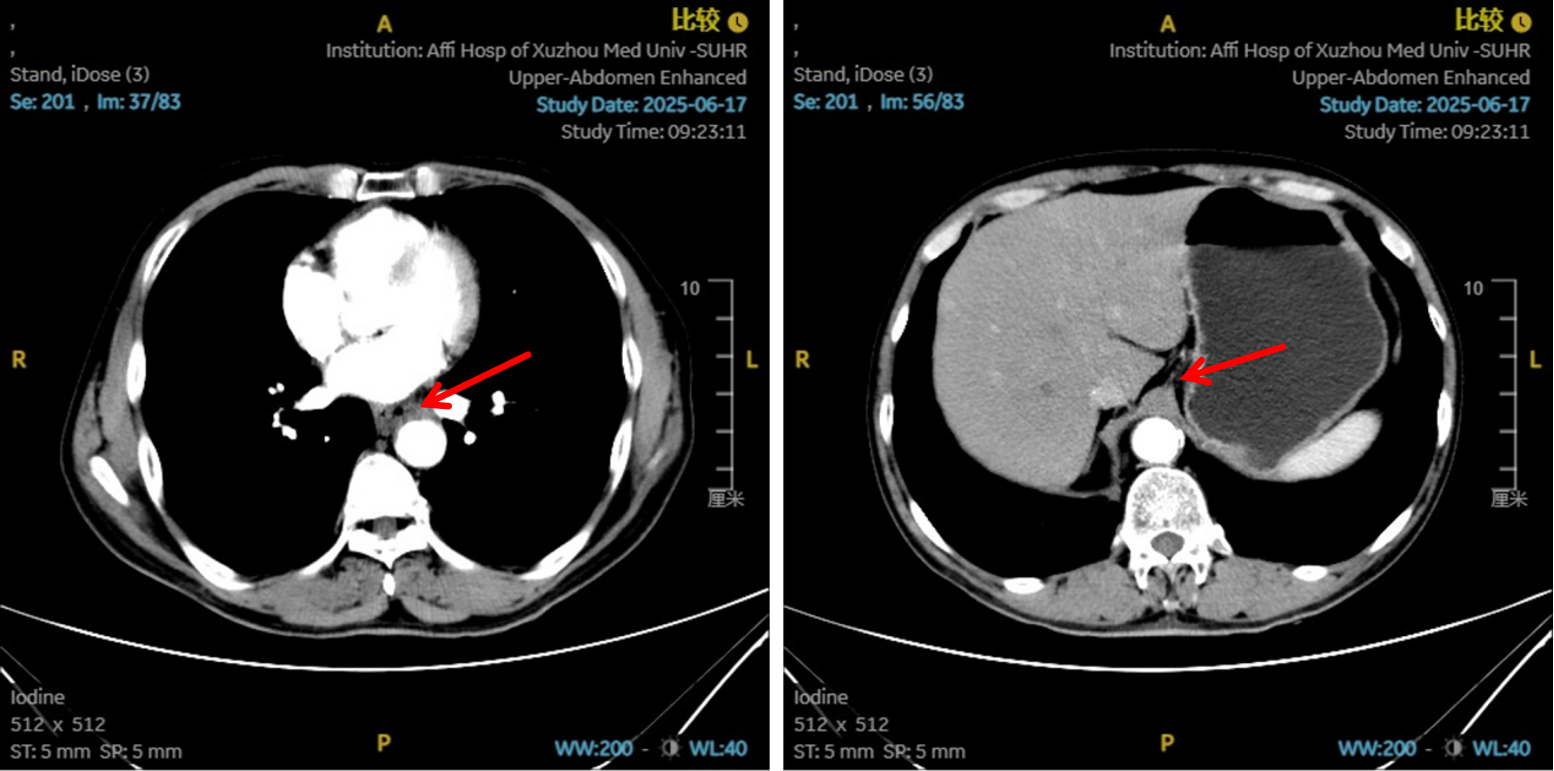
图8:6周期治疗后影像学 [图左:“食管Ca化疗后”,食管胸中下段管壁增厚,较厚处管壁约10mm,边缘模糊,病灶局部与邻近大血管、气管壁分界不清。图右:纵隔内(3P、4、7)示小淋巴结影。]
疗效评估
治疗2周期后,食管壁厚度由17mm降至15mm,淋巴结由18mm×15mm缩小至16mm×13mm;4周期后,食管壁进一步缩至12mm,淋巴结明显减少;6周期后,食管壁仅余10mm,纵隔内仅见小淋巴结影,疗效评估“接近CR”。
病例点评
在本病例中,化疗药物,特别是洛铂的选择,起到了不可或缺的作用。其优势在化免联合的背景下尤为突出:
1. 高效的肿瘤杀伤与“抗原释放”效应
化疗是快速降低肿瘤负荷最有效的手段之一。紫杉醇破坏肿瘤细胞微管系统,洛铂则通过形成铂-DNA加合物,破坏DNA复制与修复,二者协同,直接诱导肿瘤细胞凋亡。这一过程会大量释放肿瘤特异性抗原,相当于为体内的免疫细胞(T细胞)“指明目标”,极大地促进了后续免疫药物的激活效果。
2. 卓越的耐受性,保障联合治疗的连续性
在“化疗+免疫+靶向”的强强联合模式下,方案的耐受性直接决定了治疗能否顺利进行。洛铂Ⅲ期临床研究显示,其Ⅲ-Ⅳ级呕吐发生率4.9%,低于顺铂的18.7%(P<0.01),肌酐升高≥2级发生率1.1% vs 11.4%[1]。本例患者在整个治疗过程中仅出现轻微肠道反应,经对症支持治疗后可迅速缓解,保证了6个周期联合方案的足量、按时完成。
3. 潜在的免疫调节作用,与免疫治疗协同增效
近年研究发现,一些铂类药物不仅能直接杀灭肿瘤细胞,还能通过诱导“免疫原性细胞死亡(ICD)”,改变肿瘤微环境,增强免疫细胞的浸润与功能[2]。洛铂作为第三代铂类药物,在此方面展现出潜力。它与PD-1抑制剂联用,可能产生“1+1>2”的协同效应,共同逆转肿瘤的免疫抑制状态。
病例小结
本例晚期食管癌患者通过“化疗+免疫+抗血管+放疗”的综合模式,实现了肿瘤的显著退缩和病情的有效控制,且耐受性良好,不良反应轻微。未来,对于局晚期食管癌等恶性肿瘤,基于洛铂的化免联合、化免放联合等模式,有望成为进一步提高患者生存率和生活质量的探索方向。
参考文献:
[1] Lv X, Cao X, Xia WX, et al. Induction chemotherapy with lobaplatin and fluorouracil versus cisplatin and fluorouracil followed by chemoradiotherapy in patients with stage III-IVB nasopharyngeal carcinoma: an open-label, non-inferiority, randomised, controlled, phase 3 trial. Lancet Oncol. 2021 May;22(5):716-726. doi: 10.1016/S1470-2045(21)00075-9. Epub 2021 Apr 12. PMID: 33857411.
[2] Li G, Che X, Wang S, et al. The role of cisplatin in modulating the tumor immune microenvironment and its combination therapy strategies: a new approach to enhance anti-tumor efficacy. Ann Med. 2025 Dec;57(1):2447403. doi: 10.1080/07853890.2024.2447403. Epub 2025 Jan 6. PMID: 39757995; PMCID: PMC11705547.
该病例由徐州医科大学附属医院肿瘤中心提供,旨在专业交流与知识分享。个体治疗方案需在医生指导下制定。
编辑:阿希雅
审核:辛勇教授
来源:肿瘤界